下列有关化学反应方向及判据的说法中不正确的是
| A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行 |
| B.NH4HCO3(s) =NH3(g)+H2O(g)+CO2(g) ΔH =+185.57kJ·mol-1能自发进行,原因是体系有自发地向混乱度增加的方向转变的倾向 |
| C.焓变和熵变都与反应的自发性有关,但焓变或熵变不可以单独作为反应自发性的判据 |
| D.自发反应就是能较快进行的反应,非自发反应就是无法进行的反应 |
21-22高二下·河南南阳·期末 查看更多[4]
辽宁省大连市滨城高中联盟2022-2023学年高二上学期期中考试化学试题山东省潍坊实验中学2022-2023学年高二上学期第一次单元过关检测化学试题(已下线)2.3 化学反应的方向-2022-2023学年高二化学上学期课后培优分级练(人教版2019选择性必修1)河南省南阳市2021-2022学年高二下学期期末考试化学试题
更新时间:2022-07-13 08:27:57
|
相似题推荐
单选题
|
适中
(0.65)
名校
解题方法
【推荐1】对于反应2SO2(g)+O2(g)⇌2SO3(g),下列说法正确的是
| A.该反应在任何条件下都能自发进行 |
| B.反应达平衡后再通入O2,SO3的体积分数一定增加 |
| C.反应在高温、催化剂条件下进行可提高SO2的平衡转化率 |
| D.2mol SO2(g)和1mol O2(g)所含键能总和比2mol SO3(g)所含键能小 |
您最近半年使用:0次
单选题
|
适中
(0.65)
【推荐2】下列说法中正确的是
A.若  ,该化学反应在任何温度下都不能自发进行 ,该化学反应在任何温度下都不能自发进行 |
| B.知道了某过程有自发性之后,就能确定该过程是否一定会发生 |
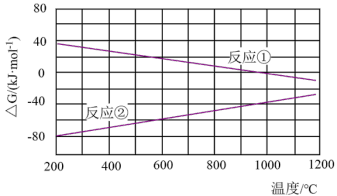
C.一定温度下,反应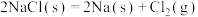 的 的  |
| D.某反应在低温条件下能自发进行,那么该反应在高温条件下也一定能自发进行 |
您最近半年使用:0次
单选题
|
适中
(0.65)
解题方法
【推荐1】下列说法正确的是
| A.凡是放热反应都是自发的,因为吸热反应都是非自发的 |
| B.自发反应的现象一定非常明显,非自发反应的熵一定减小 |
| C.体系自由能变化ΔG=ΔH-TΔS:当ΔH<0,ΔS>0时,反应能自发进行 |
| D.体系自由能变化ΔG=ΔH-TΔS:当ΔH>0,ΔS<0时,反应能自发进行 |
您最近半年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】下列说法正确的是
| A.在其他外界条件不变的情况下,增大压强能增大活化分子的百分数 |
| B.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H <0 |
| C.加入合适的催化剂能降低反应活化能,从而改变反应的焓变 |
| D.常温下,Ksp[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤ 1×10-6 mol/L,需调节溶液的pH≥5 |
您最近半年使用:0次