某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是_______ ,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是_______ ,选用指示剂是_______ 。
(2)滴定,并记录NaOH的终读数。重复滴定几次,数据记录如下表:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=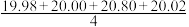 mL=20.20 mL,他的计算合理吗?理由是
mL=20.20 mL,他的计算合理吗?理由是_______ 。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作_______ ;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果_______ (填“偏大”、“偏小”或“无影响”)。
①向溶液中加入1~2滴指示剂
②取20.00mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是
(2)滴定,并记录NaOH的终读数。重复滴定几次,数据记录如下表:
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/mL(初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/mL(终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/mL(消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
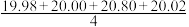 mL=20.20 mL,他的计算合理吗?理由是
mL=20.20 mL,他的计算合理吗?理由是(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作
更新时间:2022-04-12 21:31:31
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】现用盐酸标准溶液来测定NaOH溶液的浓度。有以下实验操作。
①向溶液中加入1~2滴指示剂 ②取20.00 mL标准溶液放入锥形瓶中 ③用氢氧化钠溶液滴定至终点 ④重复以上操作 ⑤配制250 mL盐酸标准溶液 ⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是_______ (填序号),上述操作②中使用的仪器除锥形瓶外,还需要_______ ,用_______ 作指示剂。
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积V(NaOH)=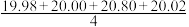 mL=20.20 mL。他的计算
mL=20.20 mL。他的计算_______ (填“合理”或“不合理”),理由是_______ 。
①向溶液中加入1~2滴指示剂 ②取20.00 mL标准溶液放入锥形瓶中 ③用氢氧化钠溶液滴定至终点 ④重复以上操作 ⑤配制250 mL盐酸标准溶液 ⑥根据实验数据计算氢氧化钠的物质的量浓度
(1)实验过程中正确的操作顺序是
(2)滴定并记录V(NaOH)的初、终读数。数据记录如表所示:
| 滴定次数 | 1 | 2 | 3 | 4 |
| V(HCl)/ mL | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)/ mL (初读数) | 0.10 | 0.30 | 0.00 | 0.20 |
| V(NaOH)/ mL (终读数) | 20.08 | 20.30 | 20.80 | 20.22 |
| V(NaOH)/ mL (消耗) | 19.98 | 20.00 | 20.80 | 20.02 |
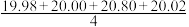 mL=20.20 mL。他的计算
mL=20.20 mL。他的计算
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐2】某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片中的其他成分不与盐酸或氢氧化钠反应):
①配制1.60mol/L稀盐酸和1.60mol/LNaOH溶液;
②向一粒研碎后的药片(1.60g)中加入20.00mL蒸馏水;
③用1.60mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL1.60mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是__________________________ (填序号)
(2)测定过程中发生反应的离子方程式为___________________________________ 、___________________________ 。
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下:
实验室现有50mL、100mL、250mL、500mL4种规格的容量瓶,则配制NaOH溶液应选用的容量瓶的规格为___________ 。
(4)①配制上述NaOH溶液时需要的主要仪器有托盘天平、烧杯、________________ 。
②该实验的第一步是计算,称取_____ gNaOH固体。
③用烧杯称取NaOH固体时,下列操作步骤的正确顺序是__________________ (相同的操作可重复使用)。
a.调整天平零点 b.将砝码放回砝码盒 c.将游码拨回零刻度处
d.称取小烧杯的质量 e.称取小烧杯和NaOH的质量 f.记录称量的数据
④称取NaOH固体时,若将砝码放在天平左盘,将NaOH固体放在右盘,游码在1.4的刻度线处。则实际称得的NaOH固体为____________ g。
⑤写出下列操作对所配制的溶液浓度造成的影响(填“偏大”“偏小”或“不变”)。
a.称量时砝码与NaOH固体在托盘中位置颠倒:______________ 。
b.未洗涤烧杯及玻璃棒:______________ 。
c.定容摇匀后,发现液面低于刻度线,重新加水至刻度线:______________ 。
⑥取50mL上述配制准确的NaOH溶液,加水稀释至100mL,所得NaOH溶液的物质的量浓度为________________ 。
①配制1.60mol/L稀盐酸和1.60mol/LNaOH溶液;
②向一粒研碎后的药片(1.60g)中加入20.00mL蒸馏水;
③用1.60mol/LNaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积;
④加入25.00mL1.60mol/L稀盐酸。
请回答下列问题:
(1)正确的操作顺序是
(2)测定过程中发生反应的离子方程式为
(3)该测定实验共进行了4次。4次测定所消耗的NaOH溶液的体积如下:
| 测定次数 | 第1次 | 第2次 | 第3次 | 第4次 |
| V【NaOH(aq)】/mL | 13.00 | 12.90 | 13.10 | 13.00 |
(4)①配制上述NaOH溶液时需要的主要仪器有托盘天平、烧杯、
②该实验的第一步是计算,称取
③用烧杯称取NaOH固体时,下列操作步骤的正确顺序是
a.调整天平零点 b.将砝码放回砝码盒 c.将游码拨回零刻度处
d.称取小烧杯的质量 e.称取小烧杯和NaOH的质量 f.记录称量的数据
④称取NaOH固体时,若将砝码放在天平左盘,将NaOH固体放在右盘,游码在1.4的刻度线处。则实际称得的NaOH固体为
⑤写出下列操作对所配制的溶液浓度造成的影响(填“偏大”“偏小”或“不变”)。
a.称量时砝码与NaOH固体在托盘中位置颠倒:
b.未洗涤烧杯及玻璃棒:
c.定容摇匀后,发现液面低于刻度线,重新加水至刻度线:
⑥取50mL上述配制准确的NaOH溶液,加水稀释至100mL,所得NaOH溶液的物质的量浓度为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学生用已知物质的量浓度的NaOH标准溶液来测定未知物质的量浓度的盐酸时,选择酚酞作指示剂。请回答下列问题:
(1)配制480mL0.1000mol/L标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、___________ 、___________ 。
(2)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;
⑥滴定操作
正确的操作顺序为:___________ 。
(3)盛装NaOH标准溶液的仪器名称为___________ ,若滴定开始和结束时,该仪器中溶液读数如图所示,所用NaOH标准溶液的体积为___________ mL。

(4)滴定过程中边滴加边摇动锥形瓶,到达滴定终点的现象是___________ 。
(5)某学生根据3次实验分别记录有关数据如表所示:
依据表中数据计算该盐酸的物质的量浓度为___________  。
。
(6)在上述实验中,下列操作会造成测定结果偏高的是____
a.放出酸液的滴定管开始有气泡,放出液体后气泡消失
b.碱式滴定管水洗后末用标准溶液润洗
c.若锥形瓶盛装标准溶液,滴定管内为待测溶液,滴定终点时俯视读数
d.锥形瓶用蒸馏水洗涤后,没有干燥就进行实验
(1)配制480mL0.1000mol/L标准溶液。配制所需的玻璃仪器有:烧杯、量筒,玻璃棒、
(2)滴定操作可分解为如下几步:
①检查滴定管是否漏水;
②取一定体积的待测液于锥形瓶中;
③用标准溶液润洗盛标准溶液的滴定管,用待测液润洗盛待测液的滴定管;
④装标准溶液和待测液并调整液面(记录初始读数);
⑤用蒸馏水洗涤玻璃仪器;
⑥滴定操作
正确的操作顺序为:
(3)盛装NaOH标准溶液的仪器名称为

(4)滴定过程中边滴加边摇动锥形瓶,到达滴定终点的现象是
(5)某学生根据3次实验分别记录有关数据如表所示:
| 滴定次数 | 待测盐酸的体积/mL | 标准NaOH溶液体积 | |
| 滴定前的刻度/mL | 滴定后的刻度/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 |
| 第三次 | 25.00 | 0.22 | 26.31 |
 。
。(6)在上述实验中,下列操作会造成测定结果偏高的是
a.放出酸液的滴定管开始有气泡,放出液体后气泡消失
b.碱式滴定管水洗后末用标准溶液润洗
c.若锥形瓶盛装标准溶液,滴定管内为待测溶液,滴定终点时俯视读数
d.锥形瓶用蒸馏水洗涤后,没有干燥就进行实验
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大损害,要进行必要的处理。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3 2NaI+Na2S4O6)
2NaI+Na2S4O6)
步骤Ⅳ:将上述反应后溶液进行pH调节、过滤等处理,回收沉淀,滤液倒入下水道。
(1)步骤Ⅰ加入稀硫酸酸化的目的是_____________________________ ;
(2)步骤Ⅱ判断滴定达到终点的现象是___________________________ ;
(3)以下操作会造成废水中铬含量测定值偏高的是_________________ ;
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72-的物质的量为___________ mol.
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:
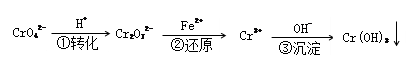
(5)能说明第①步反应达到平衡状态的是_____________ ;(填字母代号)
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要________ mol的FeSO4·7H2O。
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至___________ 。
两种离子在溶液中存在如下平衡:2CrO42-(黄色)+2H+
 Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O现对某工业废水进行检测并做沉降处理,请回答下列问题:
(一)取样该工业废水,检测其中铬的含量。
步骤Ⅰ:取25.00 mL废水,加入适量稀硫酸酸化。
步骤Ⅱ:加入过量的碘化钾溶液,Cr2O72-+6I-+14H+
 2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3
2Cr3++3I2+7H2O然后滴入几滴指示剂。步骤Ⅲ:将一定体积的0.1000mol·L-1Na2S2O3溶液装入碱式滴定管中,进行滴定操作,滴定结果如下:(I2+2Na2S2O3 2NaI+Na2S4O6)
2NaI+Na2S4O6)滴定次数 | Na2S2O3溶液起始读数/mL | Na2S2O3溶液终点读数/mL |
第一次 | 1.02 | 19.03 |
第二次 | 2.00 | 19.99 |
第三次 | 0. 20 | 18.20 |
(1)步骤Ⅰ加入稀硫酸酸化的目的是
(2)步骤Ⅱ判断滴定达到终点的现象是
(3)以下操作会造成废水中铬含量测定值偏高的是
A.滴定终点读数时,俯视滴定管的刻度
B.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
C.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
D.清洗后未用标准液润洗碱式滴定管
(4)25.00mL废水经酸化后,含有Cr2O72-的物质的量为
(二)还原沉淀法除Cr2O72-和CrO42-
该方法的工艺流程为:

(5)能说明第①步反应达到平衡状态的是
a. Cr2O72-和CrO42-的浓度相同
b. 2v(Cr2O72-)=v(CrO42-)
c.溶液的颜色不变
(6)第②步中,还原1molCr2O72-离子,需要
(7)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】某同学利用硫和少量氯气在135~ 145℃条件下反应制备S2Cl2的装置如图所示(夹持装置略):
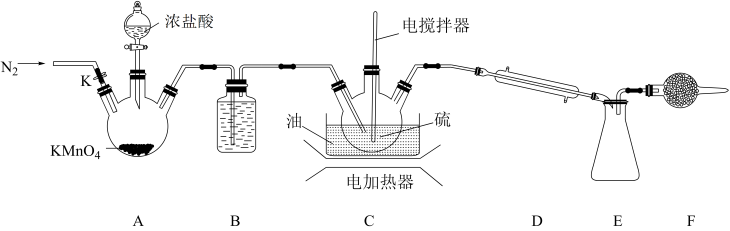
已知:
i. 2S+Cl2=S2Cl2,S2Cl2+Cl2=2SCl2;
ii. S2Cl2易挥发,在空气中可剧烈水解:2S2Cl2+2H2O=3S ↓+SO2↑+4HCl;
iii.相关物质的熔沸点:
回答下列问题:
(1)装置B中盛放的试剂为_______ (填物质名称);装置F中的试剂应选择_______ (填序号)。
a.无水CaCl2 b.碱石灰 c. P2O5 d.无水CuSO4
(2)实验操作的先后顺序为组装仪器并检验装置的气密性→加入药品→滴加浓盐酸→_______→_______→_______→通入N2→_______(填序号)。_______
①通冷凝水 ②加热装置C ③停止通冷凝水 ④停止加热装置C
(3)为提高S2Cl2的纯度,实验的关键是控制好温度和_______ 。
(4)实验结束时可采取蒸馏的方法来提纯装置E中的S2Cl2,该过程中应收集_______ ℃左右的馏分。
(5)已知: 25℃时,Ksp(AgCl)= 3.2×10-10, Ksp( AgSCN)= 2 × 10-12,为测定提纯后的S2Cl2产品的纯度,进行如下实验:
步骤①:取2.70g提纯后的S2Cl2产品(不含SCl2),加入足量Ba(OH)2溶液(杂质不参与反应),充分振荡、过滤、洗涤,将所得溶液全部移入锥形瓶,加入稀硝酸酸化,再加入过量的0. 4000mol·L-1 AgNO3溶液100. 00mL。
步骤②:向锥形瓶中加入2mL硝基苯,用力摇动使有机物充分覆盖沉淀;再滴入2滴Fe( NO3)3溶液作指示剂,用0.2000mol ·L-1KSCN标准液滴定至终点,消耗KSCN标准液10.00mL。
滴定终点的实验现象为_______ ;所得产品中S2Cl2的质量分数为_______ 。

已知:
i. 2S+Cl2=S2Cl2,S2Cl2+Cl2=2SCl2;
ii. S2Cl2易挥发,在空气中可剧烈水解:2S2Cl2+2H2O=3S ↓+SO2↑+4HCl;
iii.相关物质的熔沸点:
| 物质 | S | S2Cl2 | SCl2 |
| 熔点/℃ | 112.8 | -77 | -121 |
| 沸点/℃ | 444.6 | 137 | 59.6 |
(1)装置B中盛放的试剂为
a.无水CaCl2 b.碱石灰 c. P2O5 d.无水CuSO4
(2)实验操作的先后顺序为组装仪器并检验装置的气密性→加入药品→滴加浓盐酸→_______→_______→_______→通入N2→_______(填序号)。
①通冷凝水 ②加热装置C ③停止通冷凝水 ④停止加热装置C
(3)为提高S2Cl2的纯度,实验的关键是控制好温度和
(4)实验结束时可采取蒸馏的方法来提纯装置E中的S2Cl2,该过程中应收集
(5)已知: 25℃时,Ksp(AgCl)= 3.2×10-10, Ksp( AgSCN)= 2 × 10-12,为测定提纯后的S2Cl2产品的纯度,进行如下实验:
步骤①:取2.70g提纯后的S2Cl2产品(不含SCl2),加入足量Ba(OH)2溶液(杂质不参与反应),充分振荡、过滤、洗涤,将所得溶液全部移入锥形瓶,加入稀硝酸酸化,再加入过量的0. 4000mol·L-1 AgNO3溶液100. 00mL。
步骤②:向锥形瓶中加入2mL硝基苯,用力摇动使有机物充分覆盖沉淀;再滴入2滴Fe( NO3)3溶液作指示剂,用0.2000mol ·L-1KSCN标准液滴定至终点,消耗KSCN标准液10.00mL。
滴定终点的实验现象为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】某学生用已知物质的量浓度的盐酸测定未知物质的量浓度的NaOH溶液时选择甲基橙作指示剂,请填写下列空白
(1)用标准的盐酸滴定待测的NaOH溶液时:左手___________ ,右手___________ 眼睛注视___________ 。判断滴定终点的现象是:___________ 。
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据列式计算该NaOH溶液的物质的量浓度:___________ 。
(1)用标准的盐酸滴定待测的NaOH溶液时:左手
(2)下列操作中可能使所测NaOH溶液的浓度数值偏低的是
| A.酸式滴定管未用标准盐酸润洗就直接注入标准盐酸 |
| B.滴定前盛放NaOH溶液的锥形瓶用蒸馏水洗净但没有干燥 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数 |
| 滴定次数 | 待测NaOH溶液的体积 | 0.1000mol/L盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I.如图所示三个烧瓶中分别装入含酚酞的0.01mol•L-1CH3COONa溶液,并分别放置在盛有水的烧杯中,然后向烧杯①中加入生石灰,向烧杯③中加入NH4NO3晶体,烧杯②中不加任何物质。

(1)含酚酞的0.01mol•L-1CH3COONa溶液显浅红色的原因为______ 。
(2)实验过程中发现烧杯①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是______ (填字母)。
II.某同学用中和滴定法测定某烧碱溶液的浓度。
(I)实验步骤
(3)用图1中仪器______ (填“A”或“B”)取待测烧碱溶液25.00mL于锥形瓶中,滴加2滴酚酞作指示剂。

(4)记录盛装0.1000mol•L-1盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为______ mL。

(5)滴定。滴定过程中,眼睛应始终注视______ 。
(6)滴定终点的现象是______ 。
(II)数据记录
(III)数据处理
(7)计算该烧碱溶液的浓度c(NaOH)=______ mol•L-1(精确到小数点后4位)。
(IV)误差分析
(8)以下操作会导致测定结果偏高的是______ (填字母)。

(1)含酚酞的0.01mol•L-1CH3COONa溶液显浅红色的原因为
(2)实验过程中发现烧杯①中溶液红色变深,烧瓶③中溶液红色变浅,则下列叙述正确的是
| A.水解反应为放热反应 | B.水解反应为吸热反应 |
| C.NH4NO3溶于水时放出热量 | D.NH4NO3溶于水时吸收热量 |
II.某同学用中和滴定法测定某烧碱溶液的浓度。
(I)实验步骤
(3)用图1中仪器

(4)记录盛装0.1000mol•L-1盐酸标准溶液的酸式滴定管的初始读数。如果某时刻液面位置如图2所示,则此时的读数为

(5)滴定。滴定过程中,眼睛应始终注视
(6)滴定终点的现象是
(II)数据记录
| 实验编号 | 烧碱待测液体积V/mL | 盐酸标准液体积(消耗)V/mL |
| 1 | 25.00 | 18.05 |
| 2 | 25.00 | 18.00 |
| 3 | 25.00 | 17.95 |
| 4 | 25.00 | 18.95 |
(7)计算该烧碱溶液的浓度c(NaOH)=
(IV)误差分析
(8)以下操作会导致测定结果偏高的是
| A.未用盐酸标准溶液润洗滴定管 |
| B.装待测液前,锥形瓶中有少量蒸馏水 |
| C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失 |
| D.观察读数时,滴定前仰视,滴定后俯视 |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】甲酸是一种有机弱酸,有望成为理想的氢能储存和运输载体。
(1)常温下,测得 溶液的
溶液的 ,试计算
,试计算
_______ (用科学记数法表示,保留小数点后一位)。
(2)甲酸可通过电解法制备,其原理如图所示:

①电极a应与外接直流电源的_______ 极(填“正”或“负”)相连,生成甲酸的电极反应式为_______ 。
②电极b附近开始阶段发生的反应可能有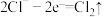 、
、_______ 等(用离子方程式表示)。
(3)某溶液中 含量的测定:取
含量的测定:取 待测溶液置于锥形瓶中,滴入2~3滴指示剂,用
待测溶液置于锥形瓶中,滴入2~3滴指示剂,用 标准溶液滴定(假设滴定时只有
标准溶液滴定(假设滴定时只有 参加反应)。
参加反应)。
①其中第三次读数时滴定管终点的液面位置如图所示,则该次滴定终点的读数为_______  。
。

②若消耗 标准溶液的平均体积为
标准溶液的平均体积为 ,则甲酸的质量浓度为
,则甲酸的质量浓度为_______  。
。
③滴定过程中,若滴定前平视刻度线读数,滴定达到终点时俯视刻度线读数,会使实验结果_______ (“偏大”“偏小”或“无影响”)。
(1)常温下,测得
 溶液的
溶液的 ,试计算
,试计算
(2)甲酸可通过电解法制备,其原理如图所示:

①电极a应与外接直流电源的
②电极b附近开始阶段发生的反应可能有
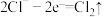 、
、(3)某溶液中
 含量的测定:取
含量的测定:取 待测溶液置于锥形瓶中,滴入2~3滴指示剂,用
待测溶液置于锥形瓶中,滴入2~3滴指示剂,用 标准溶液滴定(假设滴定时只有
标准溶液滴定(假设滴定时只有 参加反应)。
参加反应)。①其中第三次读数时滴定管终点的液面位置如图所示,则该次滴定终点的读数为
 。
。
②若消耗
 标准溶液的平均体积为
标准溶液的平均体积为 ,则甲酸的质量浓度为
,则甲酸的质量浓度为 。
。③滴定过程中,若滴定前平视刻度线读数,滴定达到终点时俯视刻度线读数,会使实验结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】如图是用0.1000mol/L的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后的盛放盐酸滴定管中液面的位置.请回答:

(1)仪器A的名称是__________________ ;
(2)盐酸的体积读数:滴定前读数为_____ mL,滴定后读数为______ mL;
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是________________ ;(保留四位有效数字)
(4)滴定操作可分解为如下几步(所用的仪器刚用蒸馏水洗净):
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)_____________ ;
(5)判断到达滴定终点的实验现象是________________________________ 。
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是_________ ;
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失._________ ;
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是___________ ;
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是___________ .

(1)仪器A的名称是
(2)盐酸的体积读数:滴定前读数为
(3)某实验小组同学的三次实验的实验数据如下表所示.根据表中数据计算出的待测NaOH溶液的浓度是
| 实验 编号 | 待测NaOH溶液的体积(mL) | 滴定前盐酸的 体积读数mL) | 滴定后盐酸的 体积读数(mL) |
| 1 | 20.00 | 1.20 | 23.22 |
| 2 | 20.00 | 2.21 | 24.21 |
| 3 | 20.00 | 1.50 | 23.48 |
A.用碱式滴定管向锥形瓶里注入20.00mL待测NaOH溶液,并加入2~3滴酚酞;
B.用标准溶液润洗酸式滴定管2~3次;
C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液,使管内无气泡;
D.取标准盐酸注入酸式滴定管至刻度0以上2~3cm;
E.调节液面至0或0以下刻度,记下读数;
F.把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点并记下滴定管液面的刻度。
正确操作步骤的顺序是(用序号字母填写)
(5)判断到达滴定终点的实验现象是
(6)对下列几种假定情况进行讨论:(填“无影响”、“偏高”、“偏低”)
①如果上述B步骤省略,对测定结果的影响是
②取待测液的滴定管,滴定前滴定管尖端有气泡,滴定后气泡消失.
③若滴定前锥形瓶未用待测液润洗,对测定结果的影响是
④标准液读数时,若滴定前仰视,滴定后俯视,对测定结果的影响是
您最近一年使用:0次



