回答下列问题:
(1)Cl2通入水中制氯水,反应的离子方程式:____ 。
(2)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式:____ 。
(3)以软锰矿(主要成分为MnO2、SiO2等)为原料制备高纯MnO2的流程如图:
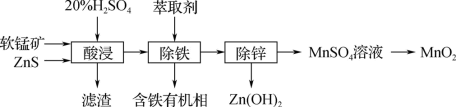
①滤渣中含大量硫单质,酸浸时主要反应的化学方程式:____ 。
②酸性条件下,用合适的氧化剂可以将MnSO4转化为高纯MnO2。用NaClO3作氧化剂时会同时产生NaCl,该反应的离子方程式:____ 。
(4)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定某次试验所得溶液中次氯酸的物质的量浓度:量取10.00mL上述次氯酸溶液,并稀释至100mL,再从其中取出10.00mL于锥形瓶中,并加入10.00mL0.8000mol/L的FeSO4溶液,充分反应后,用0.05000mol/L的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00mL,则原次氯酸溶液的浓度为____ (写出计算过程)。
(1)Cl2通入水中制氯水,反应的离子方程式:
(2)高铁酸钾(K2FeO4)被人们称为“绿色化学”净水剂。高铁酸钾在酸性至弱碱性条件下不稳定。工业上用KClO与Fe(NO3)3溶液反应制得K2FeO4,反应的离子方程式:
(3)以软锰矿(主要成分为MnO2、SiO2等)为原料制备高纯MnO2的流程如图:

①滤渣中含大量硫单质,酸浸时主要反应的化学方程式:
②酸性条件下,用合适的氧化剂可以将MnSO4转化为高纯MnO2。用NaClO3作氧化剂时会同时产生NaCl,该反应的离子方程式:
(4)已知次氯酸可被FeSO4等物质还原。用下列实验方案测定某次试验所得溶液中次氯酸的物质的量浓度:量取10.00mL上述次氯酸溶液,并稀释至100mL,再从其中取出10.00mL于锥形瓶中,并加入10.00mL0.8000mol/L的FeSO4溶液,充分反应后,用0.05000mol/L的酸性KMnO4溶液滴定至终点,消耗KMnO4溶液24.00mL,则原次氯酸溶液的浓度为
更新时间:2022-08-31 09:14:52
|
相似题推荐
计算题
|
适中
(0.65)
【推荐1】一定量的炭粉与足量18mol/L的浓硫酸充分反应。如果该反应过程中转移了0.2mol电子,试求反应中生成的气体在标准状况下的体积。____________________
您最近一年使用:0次
计算题
|
适中
(0.65)
解题方法
【推荐2】用“间接碘量法”测定CuCl2·2H2O样品的纯度,过程如下:取0.400 0 g试样溶于水,加入过量KI固体,充分反应,生成白色CuI沉淀,滴入几滴淀粉溶液作指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。(滴定反应为I2+2S2O =S4O
=S4O +2I-)
+2I-)
(1)写出生成白色CuI沉淀的离子方程式:___________ 。
(2)该样品中CuCl2·2H2O的质量分数为___________ 。
 =S4O
=S4O +2I-)
+2I-)(1)写出生成白色CuI沉淀的离子方程式:
(2)该样品中CuCl2·2H2O的质量分数为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
解题方法
【推荐3】研究物质性质及物质转化具有重要的价值。回答下列问题:
(1)已知常温下,在溶液中可发生如下反应。
① ;②
;② 。
。
反应①中还原剂为_____ ;反应②中每消耗1个 ,转移
,转移_____ 个电子。
(2)某反应的反应物与生成物有 ,已知氧化性:
,已知氧化性: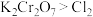 ,写出并配平该化学方程式:
,写出并配平该化学方程式:_____ 。
(3)按如图所示操作,充分反应后。

①试管Ⅰ中发生反应的化学方程式为_____ ;试管Ⅱ中铜丝上观察到的现象是_____ 。
②结合Ⅰ、Ⅱ实验现象可知 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为_____ 。
(1)已知常温下,在溶液中可发生如下反应。
①
 ;②
;② 。
。反应①中还原剂为
 ,转移
,转移(2)某反应的反应物与生成物有
 ,已知氧化性:
,已知氧化性: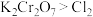 ,写出并配平该化学方程式:
,写出并配平该化学方程式:(3)按如图所示操作,充分反应后。

①试管Ⅰ中发生反应的化学方程式为
②结合Ⅰ、Ⅱ实验现象可知
 的氧化性由强到弱的顺序为
的氧化性由强到弱的顺序为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐1】(1)2molO3和3molO2的质量之比_______ ,分子数之比______ ,同温同压下密度之比________ ,含氧原子数之比______ ,体积之比______ 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10LO3与______ LCl2的消毒能力相当。
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10mLA受热分解生成15mLO2和10mLF2,则A的化学式为_________ 。
(2)O3与Cl2具有相似的性质,均可用于自来水的消毒。已知二者在消毒时均被还原为最低价态,则相同状况下10LO3与
(3)气体化合物A分子式可表示为OxFy,已知同温同压下10mLA受热分解生成15mLO2和10mLF2,则A的化学式为
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐1】黄铁矿主要成分是 FeS2。某硫酸厂在进行黄铁矿成分测定时,取 0.1000 g 样品在空气中充分灼烧,将生成的SO2气体与足量Fe2(SO4)3溶液完全反应后,用浓度为 0.02000 mol·L-1的 K2Cr2O7标准溶液滴定至终点,重复实验,平均消耗K2Cr2O7标准溶液 20.00mL。
(1)硫酸工业中煅烧黄铁矿的设备名称_____ 。
(2)该样品FeS2的质量分数为_____ ;
(1)硫酸工业中煅烧黄铁矿的设备名称
(2)该样品FeS2的质量分数为
您最近一年使用:0次
计算题
|
适中
(0.65)
【推荐2】为测定草酸亚铁晶体(FeC2O4·xH2O)的x值,用硫酸溶解5.400 g草酸亚铁晶体,定容至250 mL。取25.00 mL溶液,用0.1000 mol·L-1 KMnO4标准溶液滴定至终点。重复实验,数据如下:
已知:MnO +FeC2O4·xH2O+H+→Mn2++Fe3++CO2↑+H2O,假设杂质不参加反应。
+FeC2O4·xH2O+H+→Mn2++Fe3++CO2↑+H2O,假设杂质不参加反应。
(1)在FeC2O4·xH2O中x=___________ 。
(2)取25.00 mL溶液,用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,在标准状况下,生成二氧化碳气体___________ mL。
| 序号 | 滴定前读数/mL | 滴定终点读数/mL |
| 1 | 0.00 | 17.98 |
| 2 | 1.24 | 20.38 |
| 3 | 1.44 | 19.46 |
已知:MnO
 +FeC2O4·xH2O+H+→Mn2++Fe3++CO2↑+H2O,假设杂质不参加反应。
+FeC2O4·xH2O+H+→Mn2++Fe3++CO2↑+H2O,假设杂质不参加反应。(1)在FeC2O4·xH2O中x=
(2)取25.00 mL溶液,用0.1000 mol·L-1 KMnO4标准溶液滴定至终点,在标准状况下,生成二氧化碳气体
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐3】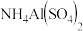 、
、 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:
(1)常温时,
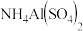 溶液的
溶液的 。
。
则溶液中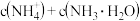
______ c 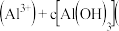 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;
;
______ 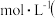 填数值
填数值 。
。
(2)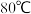 时,
时,
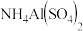 溶液的pH小于3,分析导致pH随温度变化的原因是
溶液的pH小于3,分析导致pH随温度变化的原因是__________________________________________  用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答 。
。
(3)常温时,向100mL
 溶液中滴加
溶液中滴加  NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为_________________ 。

(4)浓度均为 溶液和
溶液和 溶液,其中
溶液,其中______ 溶液 大。
大。
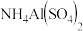 、
、 用途广泛。请回答下列问题:
用途广泛。请回答下列问题:(1)常温时,

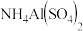 溶液的
溶液的 。
。则溶液中
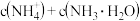
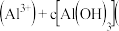 填“
填“ ”、“
”、“ ”或“
”或“ ”
” ;
;
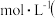 填数值
填数值 。
。(2)
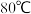 时,
时,
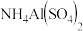 溶液的pH小于3,分析导致pH随温度变化的原因是
溶液的pH小于3,分析导致pH随温度变化的原因是 用离子方程式并结合文字叙述回答
用离子方程式并结合文字叙述回答 。
。(3)常温时,向100mL

 溶液中滴加
溶液中滴加  NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向
NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示。向 溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
溶液中滴加NaOH溶液到a点的过程中,发生反应的离子方程式为
(4)浓度均为
 溶液和
溶液和 溶液,其中
溶液,其中 大。
大。
您最近一年使用:0次



