某化学小组研究草酸(H2C2O4)及其盐的性质。
(1)已知:H2C2O4 H++HC2O
H++HC2O ,HC2O
,HC2O
 H++C2O
H++C2O
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是____ 。
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是____ (填字母)。
a.c(K+)>c(C2O )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
b.c(H+)+c(K+)=c(OH-)+c(HC2O )+c(C2O
)+c(C2O )
)
c.c(K+)=2[c(C2O )+c(HC2O
)+c(HC2O )+c(H2C2O4)]
)+c(H2C2O4)]
(2)C2O 中碳元素的化合价是+3价,推测其有还原性。文献表明:相同条件下,C2O
中碳元素的化合价是+3价,推测其有还原性。文献表明:相同条件下,C2O 的还原性强于Fe2+的。为验证此结论,小组同学完成了如下实验:向10mL0.5mol•L-1FeCl3溶液中缓慢加入0.5mol•L-1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于Fe2+的。为验证此结论,小组同学完成了如下实验:向10mL0.5mol•L-1FeCl3溶液中缓慢加入0.5mol•L-1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体
Fe3++3C2O
 [Fe(C2O4)3]3- K=1.6×1020
[Fe(C2O4)3]3- K=1.6×1020
①取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是_____ 。
②经检验反应后的溶液中无Fe2+,从反应原理的角度解释C2O 和Fe3+未发生氧化还原反应的可能原因是
和Fe3+未发生氧化还原反应的可能原因是_____ 。
③某同学利用如图所示装置比较Fe2+和C2O 的还原性强弱。
的还原性强弱。
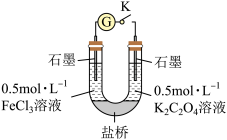
i.闭合K,电流计指针偏转,一段时间后,取左侧溶液,_____ (填操作和现象),证实C2O 的还原性强于Fe2+。
的还原性强于Fe2+。
ii.该装置的优点是____ 。
(1)已知:H2C2O4
 H++HC2O
H++HC2O ,HC2O
,HC2O
 H++C2O
H++C2O
①将等物质的量浓度、等体积的H2C2O4溶液与KOH溶液混合,反应的离子方程式是
②向①中继续加入KOH溶液至恰好完全反应,得到K2C2O4溶液。下列关系正确的是
a.c(K+)>c(C2O
 )>c(OH-)>c(H+)
)>c(OH-)>c(H+)b.c(H+)+c(K+)=c(OH-)+c(HC2O
 )+c(C2O
)+c(C2O )
)c.c(K+)=2[c(C2O
 )+c(HC2O
)+c(HC2O )+c(H2C2O4)]
)+c(H2C2O4)](2)C2O
 中碳元素的化合价是+3价,推测其有还原性。文献表明:相同条件下,C2O
中碳元素的化合价是+3价,推测其有还原性。文献表明:相同条件下,C2O 的还原性强于Fe2+的。为验证此结论,小组同学完成了如下实验:向10mL0.5mol•L-1FeCl3溶液中缓慢加入0.5mol•L-1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。
的还原性强于Fe2+的。为验证此结论,小组同学完成了如下实验:向10mL0.5mol•L-1FeCl3溶液中缓慢加入0.5mol•L-1K2C2O4溶液至过量,充分反应后得到翠绿色溶液和翠绿色晶体。资料:三水三草酸合铁酸钾[K3Fe(C2O4)3•3H2O]为翠绿色晶体
Fe3++3C2O

 [Fe(C2O4)3]3- K=1.6×1020
[Fe(C2O4)3]3- K=1.6×1020①取少量晶体洗净,配成溶液,滴加KSCN溶液,不变红,继续加入硫酸,溶液变红。用平衡移动原理解释溶液变红的原因是
②经检验反应后的溶液中无Fe2+,从反应原理的角度解释C2O
 和Fe3+未发生氧化还原反应的可能原因是
和Fe3+未发生氧化还原反应的可能原因是③某同学利用如图所示装置比较Fe2+和C2O
 的还原性强弱。
的还原性强弱。
i.闭合K,电流计指针偏转,一段时间后,取左侧溶液,
 的还原性强于Fe2+。
的还原性强于Fe2+。ii.该装置的优点是
更新时间:2022-09-02 00:33:59
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
较易
(0.85)
名校
【推荐1】氯化亚铜(CuCl)是常用的催化剂。以低品位铜矿(主要成分为CuS、 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:
(1)“氧化浸取”。铜元素全部转化为 ,铁元素全部转化为
,铁元素全部转化为 。
。
① 、
、 和硫酸反应生成
和硫酸反应生成 、
、 和S,其化学方程式为
和S,其化学方程式为_______ 。
②为提高铜元素的浸出率,工艺上可采取的措施有_______ (填字母)。
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量
C.适当缩短反应时间 D.适当提高硫酸浓度
(2)“除铁锰”。依次用氨水沉铁、用氨水- 混合溶液沉锰。
混合溶液沉锰。
①用氨水调节溶液的pH为3时, 为
为_______  。(常温下,
。(常温下,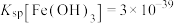 )
)
②向除铁后的溶液中滴加氨水- 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为_______ 。
(3)“还原”。 溶液、NaCl溶液和
溶液、NaCl溶液和 溶液反应生成CuCl沉淀。已知:CuCl易被
溶液反应生成CuCl沉淀。已知:CuCl易被 氧化,易与
氧化,易与 形成可溶的
形成可溶的 。
。
①反应生成CuCl的离子方程式为_______ 。
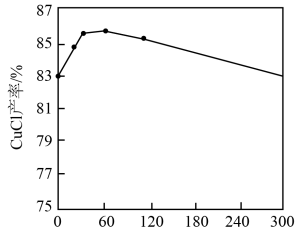
②如图所示,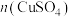 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是_______ 。
③如图所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是_______ 。
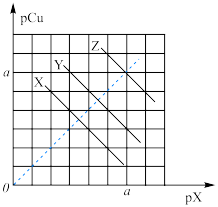
(4)已知:pCu=-lg c(Cu+),pX=-lg c(X-),式中X-表示卤素阴离子。298 K时,Ksp(CuCl)≈1.0×10-7,Ksp(CuBr)≈1.0×10-9,Ksp(CuI)≈1.0×10-12。298K时,CuCl、CuBr、CuI的饱和溶液中pCu和pX的关系如图所示。图中X代表_______ 的曲线,且a=_______ 。
 和铁的氧化物等)为原料制备CuCl步骤如下:
和铁的氧化物等)为原料制备CuCl步骤如下:(1)“氧化浸取”。铜元素全部转化为
 ,铁元素全部转化为
,铁元素全部转化为 。
。①
 、
、 和硫酸反应生成
和硫酸反应生成 、
、 和S,其化学方程式为
和S,其化学方程式为②为提高铜元素的浸出率,工艺上可采取的措施有
A.将铜矿粉碎并搅拌 B.增加铜矿的投料量
C.适当缩短反应时间 D.适当提高硫酸浓度
(2)“除铁锰”。依次用氨水沉铁、用氨水-
 混合溶液沉锰。
混合溶液沉锰。①用氨水调节溶液的pH为3时,
 为
为 。(常温下,
。(常温下,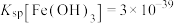 )
)②向除铁后的溶液中滴加氨水-
 混合溶液,反应生成
混合溶液,反应生成 的离子方程式为
的离子方程式为(3)“还原”。
 溶液、NaCl溶液和
溶液、NaCl溶液和 溶液反应生成CuCl沉淀。已知:CuCl易被
溶液反应生成CuCl沉淀。已知:CuCl易被 氧化,易与
氧化,易与 形成可溶的
形成可溶的 。
。①反应生成CuCl的离子方程式为
②如图所示,
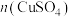 和其他条件相同时,CuCl产率随
和其他条件相同时,CuCl产率随 增大先升高后降低的原因是
增大先升高后降低的原因是
③如图所示,其他条件相同时,CuCl产率随反应时间延长而降低的原因是

(4)已知:pCu=-lg c(Cu+),pX=-lg c(X-),式中X-表示卤素阴离子。298 K时,Ksp(CuCl)≈1.0×10-7,Ksp(CuBr)≈1.0×10-9,Ksp(CuI)≈1.0×10-12。298K时,CuCl、CuBr、CuI的饱和溶液中pCu和pX的关系如图所示。图中X代表

您最近一年使用:0次
【推荐2】磷石膏是湿法生产磷酸的固体废弃物,用磷石膏生产硫酸或硫,既可减少对环境的污染又可使资源循环利用。回答下列问题:
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I.CaSO4(s)+2C(s)=CaS(s)+2CO2(g) △H1=+226 kJ∙mol−1
II.3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) △H2=a kJ∙mol−1
III.3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) △H3=b kJ∙mol−1
①反应(I)能在___________ (填“低温”“高温”或“任何温度”)下自发进行。
②用硫磺还原CaSO4反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2(g),其△H=___________ kJ·mol-1(用含a、b的代数式表示)。
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3 CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=___________ [已知:Ksp(CaCO3)=2.5×10−9,Ksp(CaSO4)=3.2×10−7]。
(3)一氧化碳还原CaSO4可发生下列反应,其lg Kp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。
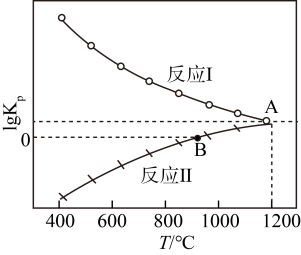
I.SO2(g)+3CO(g) 2CO2(g)+COS(g)
2CO2(g)+COS(g)
II.CaSO4(s)+CO(g) CaO(s)+CO2(g)+SO2(g)
CaO(s)+CO2(g)+SO2(g)
①△H>0的反应是___________ (填“I”或“II”)。
②在交点A处,气体分压间满足的关系是:p(COS)=___________ 。
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是___________ (填字母)。
a.2v(CO)正=3v(CO2)正 b.气体的密度不再随时间变化
c.气体的压强不再随时间变化 d. 的值不再随时间而变化
的值不再随时间而变化
④若在1.0 L的恒容密闭容器中加入1 mol CaSO4,并充入1 mol CO,只发生反应II,在B点时气体总压强为1 MPa,则此时CaSO4转化率为___________ (已知 ≈1.41)。
≈1.41)。
(1)用焦炭、硫磺等均可还原磷石膏。已知下列反应:
I.CaSO4(s)+2C(s)=CaS(s)+2CO2(g) △H1=+226 kJ∙mol−1
II.3CaSO4(s)+CaS(s)=4CaO(s)+4SO2(g) △H2=a kJ∙mol−1
III.3CaS(s)+CaSO4(s)=4CaO(s)+4S(s) △H3=b kJ∙mol−1
①反应(I)能在
②用硫磺还原CaSO4反应为2CaSO4(s)+S(s)=2CaO(s)+3SO2(g),其△H=
(2)磷石膏转氨法制硫酸的主要反应为CaSO4(s)+(NH4)2CO3
 CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=
CaCO3(s)+(NH4)2SO4,该反应的平衡常数K=(3)一氧化碳还原CaSO4可发生下列反应,其lg Kp与温度(T)的关系如图所示(Kp为以分压表示的平衡常数)。

I.SO2(g)+3CO(g)
 2CO2(g)+COS(g)
2CO2(g)+COS(g)II.CaSO4(s)+CO(g)
 CaO(s)+CO2(g)+SO2(g)
CaO(s)+CO2(g)+SO2(g)①△H>0的反应是
②在交点A处,气体分压间满足的关系是:p(COS)=
③在恒温恒容密闭容器中进行反应(I),能说明已达到平衡状态的是
a.2v(CO)正=3v(CO2)正 b.气体的密度不再随时间变化
c.气体的压强不再随时间变化 d.
 的值不再随时间而变化
的值不再随时间而变化④若在1.0 L的恒容密闭容器中加入1 mol CaSO4,并充入1 mol CO,只发生反应II,在B点时气体总压强为1 MPa,则此时CaSO4转化率为
 ≈1.41)。
≈1.41)。
您最近一年使用:0次
解答题-原理综合题
|
较易
(0.85)
名校
解题方法
【推荐3】一氧化碳是一种重要的化工原料。结合所学知识回答下列问题:
(1)工业上可通过CO和H2化合制取CH3OH:
CO(g)+2H2(g) CH3OH(g) △H1
CH3OH(g) △H1
已知:①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
则△H1=___ 。
(2)二氧化碳的回收利用是环保领域研究的热点课题。
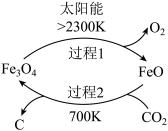
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为___ 。
(3)工业上还可通过CO和Cl2化合制取光气(COCl2):Cl2(g) +CO(g)=COCl2(g) △H。向密闭容器中充入1molCl2(g)和1molCO(g),反应速率随温度的变化如图所示。

①图中Q点的含义是___ ,△H___ 0(填“>”或“<”)。
②某温度下,该反应达到平衡时c(COCl2)=0.80mol•L-1,c(Cl2)=0.20mol•L-1,则平衡体系中CO的体积分数为___ (保留2位小数)。在该温度下,反应的平衡常数K=___ 。
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图:

①b电极的名称是___ 。
②生成丙烯(C3H6)的电极反应式为___ 。
(1)工业上可通过CO和H2化合制取CH3OH:
CO(g)+2H2(g)
 CH3OH(g) △H1
CH3OH(g) △H1已知:①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.1kJ·mol-1
②CO2(g)+3H2(g)=CH3OH(g)+H2O(g) △H3=-49.0kJ·mol-1
则△H1=
(2)二氧化碳的回收利用是环保领域研究的热点课题。
在太阳能的作用下,以CO2为原料制取炭黑的流程如图所示。其总反应的化学方程式为

(3)工业上还可通过CO和Cl2化合制取光气(COCl2):Cl2(g) +CO(g)=COCl2(g) △H。向密闭容器中充入1molCl2(g)和1molCO(g),反应速率随温度的变化如图所示。

①图中Q点的含义是
②某温度下,该反应达到平衡时c(COCl2)=0.80mol•L-1,c(Cl2)=0.20mol•L-1,则平衡体系中CO的体积分数为
(4)以稀硫酸为电解质溶液,利用太阳能将CO2转化为低碳烯烃,工作原理如图:

①b电极的名称是
②生成丙烯(C3H6)的电极反应式为
您最近一年使用:0次



