均由两种短周期元素组成的A、B、C、D化合物分子,都含有18个电子,它们分子中所含原子的数目依次为2、3、4、6.A和C分子中的原子个数比为1:1,B和D分子中的原子个数比为1:2.D可作为火箭推进剂的燃料。请回答下列问题:
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为_____ (用元素符号回答)。
(2)A与HF相比,其熔、沸点较低,原因是_______ 。
(3)B分子的空间构型为_______ 形,该分子属于______ 分子。(填“极性”或“非极性”)
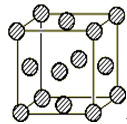
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式:________ ,该反应中反应物Cu原子的基 态电子排布式为_______ 。铜晶体中铜原子的堆积方式为面心立方堆积,如图是铜晶体一个晶胞的示意图,则晶胞中含_______ 个铜原子。
(5)D分子中心原子的杂化方式是_____ ,由该原子组成的单质分子中包含______ 个π键,与该单质分子互为等电子体的常见分子的分子式为______ 。
(1)A、B、C、D分子中相对原子质量较大的四种元素第一电离能由大到小排列的顺序为
(2)A与HF相比,其熔、沸点较低,原因是
(3)B分子的空间构型为
(4)C为一种绿色氧化剂,有广泛应用。请写出Cu、稀H2SO4与C反应制备硫酸铜的离子方程式:

(5)D分子中心原子的杂化方式是
12-13高二下·福建漳州·阶段练习 查看更多[3]
2015-2016学年山西省朔州市右玉一中高二下5月月考化学试卷2015-2016学年山西省右玉一中高二5月月考化学试卷(已下线)2012-2013学年福建省长泰县第二中学高二下学期第二次月考化学试卷
更新时间:2016-12-08 20:31:46
|
相似题推荐
填空题
|
较难
(0.4)
名校
【推荐1】亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
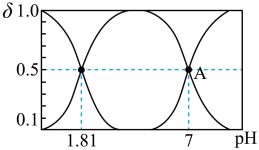
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于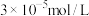 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于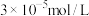 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f 3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
| a | b | ||||||||||||||||
| c | d | e | |||||||||||||||
| f | g | ||||||||||||||||
试回答下列问题(凡涉及的物质均用化学式表示):
(1)a的氢化物的分子构型为 ,中心原子的杂化形式为 ;d的最高价氧化物的分子构型为 ,中心原子的杂化形式为 ,该分子是 (填“极性”或“非极性”)分子。
(2)b、d、e三种元素的氢化物中的沸点最高的是 ,原因是: 。
(3)将g的无水硫酸盐溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子,写出该配合离子的结构简式(必须将配位键表示出来) 。
(4)f(NH3)5BrSO4可形成两种配合物 ,已知f 3+ 的配位数是6,为确定f的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,第二种配合物的化学式为 ,该配合物的配体是 、 ;
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】元素周期表中第ⅦA族元素的单质及其化合物的用途广泛。
(1)Cl2的电子式是_______ 。新制的氯水可用于漂白,工业上将氯气制成漂白粉的目的是_________ ,漂白粉是一种_______ (填“混合物”或“纯净物”)。
(2)碘元素在元素周期表中的位置是_________________ ;为防缺碘,食盐中常添加碘酸钾,该物质内存在_________ 键(填化学键类型)。
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是_______ 。
(4)已知:X2(g)+H2(g) 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
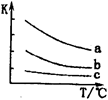
① H表示X2与H2反应的晗变,H
H表示X2与H2反应的晗变,H____ 0。(填“>”、“<”或“=”)
②曲线a表示的是________ (填“Cl2”、“Br2”或“I2”)与H2反应时K与T的关系。
(1)Cl2的电子式是
(2)碘元素在元素周期表中的位置是
(3)溴单质是唯一常温下呈液态的非金属单质,液溴的保存通常采取的方法是
(4)已知:X2(g)+H2(g)
 2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
2HX(g) (X2表示Cl2、Br2和I2)。下图表示平衡常数K与温度T的关系。
①
 H表示X2与H2反应的晗变,H
H表示X2与H2反应的晗变,H②曲线a表示的是
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐1】(1)硼酸(H3BO3)是一种白色固体,可溶于水,其水溶液为一元弱酸。硼酸分子中硼原子的杂化类型为______________ ;写出硼酸在水溶液中电离方程式 +H2O
+H2O
_______ 。
(2)CS2、NO2+具有相同的通式AX2,它们的价电子总数都是16。 CO32-、NO3-等微粒具有相同的通式:_______ ,它们的价电子总数是______________ ,因此它们与由第VIA族两元素组成的___________________ (填分子式)分子结构相同,呈______ 形。
(3)一个尿素[CO(NH2)2]分子中含有______ 个 键;1 mol化合物Fe(CO)5分子中所含
键;1 mol化合物Fe(CO)5分子中所含 键数目为
键数目为_________ 。
 +H2O
+H2O
(2)CS2、NO2+具有相同的通式AX2,它们的价电子总数都是16。 CO32-、NO3-等微粒具有相同的通式:
(3)一个尿素[CO(NH2)2]分子中含有
 键;1 mol化合物Fe(CO)5分子中所含
键;1 mol化合物Fe(CO)5分子中所含 键数目为
键数目为
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】由N、B等元素组成的新型材料有着广泛用途。
(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为_________ (填离子符号,填一个)。
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的轨道杂化类型为___________ 。
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式_________________ ;基态Ti3+的未成对电子数有___ 个,BH4-的立体构型是________ ;其中所含化学键的类型有________ ;
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3
与上述化学方程式有关的叙述不正确的是_________ 。
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
①磷化硼晶体属于______ 晶体;晶体中是否含有配位键:_______ 。
②晶体中B原子的配位数为____ 。
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是___________________ 。图2是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置____ 。其中“●”代表B原子,“×”代表N原子。

(1)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅的制造;由第二周期元素组成的与BCl3互为等电子体的阴离子为
(2)氨硼烷(H3N→BH3)和Ti(BH4)3均为广受关注的新型化学氢化物储氢材料.
①H3N→BH3中B原子的轨道杂化类型为
②Ti(BH4)3由TiCl3和LiBH4反应制得,写出该制备反应的化学方程式
③氨硼烷可由六元环状化合物(HB=NH)3通过如下反应制得:
3CH4+2(HB=NH)3+6H2O→3CO2+6H3BNH3
与上述化学方程式有关的叙述不正确的是
A.氨硼烷中存在配位键
B.第一电离能:N>O>C>B
C.反应前后碳原子的轨道杂化类型不变
D.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
(3)磷化硼(BP)是受到高度关注的耐磨材料,如图1为磷化硼晶胞;
①磷化硼晶体属于
②晶体中B原子的配位数为
(4)立方氮化硼是一种新型的超硬、耐磨、耐高温的结构材料,其结构和硬度都与金刚石相似,但熔点比金刚石低,原因是

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是________ (填元素符号),其中C原子的核外电子排布式为__________________ 。
(2)单质A有两种同素异形体,其中沸点高的是______ (填分子式),原因是__________________________________________ ;A和B的氢化物所属的晶体类型分别为________ 和________ 。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________ ,中心原子的杂化轨道类型为________ 。
(4)化合物D2A的立体构型为________ ,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为_______________________________________________ 。
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为________ ;晶体F的密度(g·cm-3 )________________________________ 。(列出表达式)
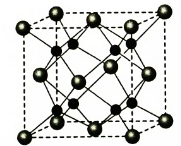
(1)四种元素中电负性最大的是
(2)单质A有两种同素异形体,其中沸点高的是
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为
(4)化合物D2A的立体构型为
(5)A和B能够形成化合物F,其晶胞结构如图所示,晶胞参数a=0.566 nm,F的化学式为

您最近一年使用:0次



