中国“长征二号F”遥八运载火箭于北京时间11月1日清晨5时58分07秒在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:

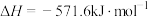
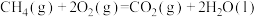


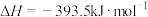
根据上面的热化学方程式完成下列问题;
(1)通过计算说明等质量的 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是_______ ,等物质的量 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是_______ 。
(2)根据以上反应,则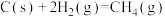 的焓变
的焓变
_______ 。
(3)已知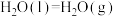
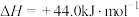 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式_______ 。
(4)若混合物 和
和 的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则
的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则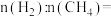
_______ 。
已知下面在298K时的热化学方程式:

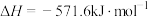
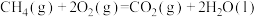


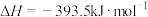
根据上面的热化学方程式完成下列问题;
(1)通过计算说明等质量的
 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是 、
、 、C完全燃烧时放出热量最多的是
、C完全燃烧时放出热量最多的是(2)根据以上反应,则
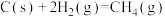 的焓变
的焓变
(3)已知
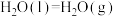
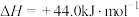 ,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式
,试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式(4)若混合物
 和
和 的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则
的总物质的量为3mol,且完全燃烧放出2066.4kJ的能量,则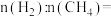
更新时间:2022-09-07 19:06:59
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】Ⅰ:为使空气质量达标,完成二氧化硫,氮氧化物排放量下降的目标,离不开各种化学处理方法。一定条件下, 用CO处理燃煤烟气中的SO2可生成液态硫, 实现硫的回收。
已知: 2CO(g)+O2(g) 2CO2(g) △H=-566kJ·mol-1
2CO2(g) △H=-566kJ·mol-1
S(l)+O2(g) SO3(g) △H=-296kJ·mol-1
SO3(g) △H=-296kJ·mol-1
则用CO处理燃煤烟气中SO2的热化学方程式是___________________ 。
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:
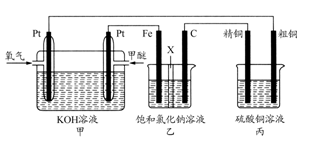
(1)甲醚燃料电池的负极反应式____________ 。
(2)石墨电极(C)的电极反应式为____________________________________ 。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将____________ (填“增大”“减小”或“不变”)。
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为____________ ;则乙装置中生成标况下气体的体积为____________ 。
已知: 2CO(g)+O2(g)
 2CO2(g) △H=-566kJ·mol-1
2CO2(g) △H=-566kJ·mol-1S(l)+O2(g)
 SO3(g) △H=-296kJ·mol-1
SO3(g) △H=-296kJ·mol-1则用CO处理燃煤烟气中SO2的热化学方程式是
Ⅱ:如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。根据要求回答相关问题:

(1)甲醚燃料电池的负极反应式
(2)石墨电极(C)的电极反应式为
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(4)若在标准状况下,有2.24L氧气参加反应,丙装置中阴极析出铜的质量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】秋冬季是雾霾高发季节,其中汽车尾气和燃煤尾气是造成雾霾的主要原因之一。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g) 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
CH4(g)+4NO(g) 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
甲烷直接将NO2还原为N2的热化学方程式为_______________________________ 。
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g) N2(g)+2CO2(g) △H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g) △H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
①下列可判断反应达到平衡状态的是___________ (填字母代号)。
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=________ 。
③为了提高尾气处理的效果,可采取的措施有_____________________ (写出两种即可)。
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式___________________ 。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO 、NO
、NO (两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO
(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如下图所示。
转化为无毒物质,同时再生Ce4+,其原理如下图所示。

①Ce4+从电解槽的_____ (填字母代号)口流出。
②写出阴极的电极反应式:______________ 。
(1)工业上利用甲烷催化还原NOX可减少氮氧化物的排放。已知:
CH4(g)+4NO2(g)
 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/mol
4NO(g)+CO2(g)+2H2O(g) △H=-574kJ/molCH4(g)+4NO(g)
 2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol
2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ/mol甲烷直接将NO2还原为N2的热化学方程式为
(2)汽车尾气催化净化是控制汽车尾气排放、减少汽车尾气污染的最有效的手段,主要原理为2NO(g)+2CO(g)
 N2(g)+2CO2(g) △H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:
N2(g)+2CO2(g) △H<O。向一定条件下的恒容密闭容器中充入NO和CO,用传感器测得该反应在不同时刻NO和CO的浓度如下表所示:| 时间/s | 0 | 1 | 2 | 3 | 4 |
| c(NO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
| c(CO)/mol·L-1 | 9.00×10-3 | 4.00×10-3 | 2.00×10-3 | 1.00×10-3 | 1.00×10-3 |
A.c(NO)不再改变 B.c(NO)/c(CO)不再改变
C.c(NO)/c(CO2)不再改变 D.V(CO)=V(CO2)
②此条件下达到平衡时,计算该反应的平衡常数K=
③为了提高尾气处理的效果,可采取的措施有
(3)工业上常采用“碱溶液吸收”的方法来同时吸收SO2和氮的氧化物气体(NOx),请写出氢氧化钠溶液吸收NO和NO2(两者体积比1:1)的离子方程式
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO
 、NO
、NO (两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO
(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO 转化为无毒物质,同时再生Ce4+,其原理如下图所示。
转化为无毒物质,同时再生Ce4+,其原理如下图所示。
①Ce4+从电解槽的
②写出阴极的电极反应式:
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐3】氮氧化物、二氧化硫是造成大气污染的主要物质,某科研小组进行如下研究。
(1)已知:

写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式___________________ 。
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。
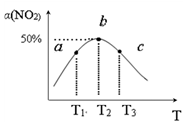
①a、c两点反应速率大小关系:υ(a)________ υ(c)。(填“>”、“<”或“=”)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为_____________ ,此温度下该反应的平衡常数为____________ ,若在此温度下,保持容器的容积不变,再向容器中充入0.20molNO2和0.30mol SO2,NO2的转化率_________________ 。(填“增大”、“减小”或“不变”)
③NO2的转化率随温度升高先增大后减小的原因是:____________________ 。
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32―)∶n(HSO3―)变化关系如下表:
①当吸收液呈中性时,溶液中离子浓度由大到小排列顺序为______________ 。
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式_____________ 。
(1)已知:

写出SO2(g)与NO2(g)反应生成SO3(g)和NO(g)的热化学方程式
(2)向容积为1L密闭容器中分别充入0.10molNO2和0.15mol SO2,在不同温度下测定同一时刻NO2的转化率,结果如图所示。

①a、c两点反应速率大小关系:υ(a)
②温度为T2时从反应开始经过2min达到b点,用SO3表示这段时间的反应速率为
③NO2的转化率随温度升高先增大后减小的原因是:
(3)常温下用NaOH溶液吸收SO2,在吸收过程中,溶液pH随n(SO32―)∶n(HSO3―)变化关系如下表:
| n(SO32―)∶n(HSO3―) | 91∶9 | 1∶1 | 9∶91 |
| pH | 8.2 | 7.2 | 6.2 |
②当向NaOH溶液中通入足量的SO2时,得到NaHSO3溶液,在pH为4~7之间电解,硫元素在阴极上被还原为Na2S2O4,这是电化学脱硫技术之一,写出该阴极的电极反应式
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】按要求答题
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是________
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:
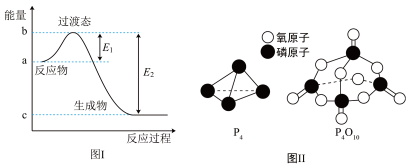
①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是________ (填“增大”“减小”或“不变”,下同),ΔH的变化是________ 。NO2和CO反应的热化学方程式为________ 。
②下表所示是部分化学键的键能参数:
已知P4(g)+5O2(g) P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=
P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=________ (用含a、b、c、d的代数式表示)。
(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是________ 。
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为________ kJ。
(1)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25℃、101kPa下,已知该反应每消耗1molCuCl(s),放热44.4kJ,该反应的热化学方程式是
(2)已知E1=134kJ·mol-1、E2=368kJ·mol-1,请参考题中图表,按要求填空:

①图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2(g)和NO(g)过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率加快,E1的变化是
②下表所示是部分化学键的键能参数:
| 化学键 | P—P | P—O |  |  |
| 键能/(kJ·mol-1) | a | b | C | x |
已知P4(g)+5O2(g)
 P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=
P4O10(g)ΔH=-dkJ·mol-1,P4及P4O10的结构如图Ⅱ所示。表中x=(3)肼(N2H4)是一种可燃性的液体,可用作火箭燃料。燃烧时释放大量的热并快速产生大量气体。已知在101kPa、298K时,1mol液态N2H4在O2中完全燃烧生成N2和水蒸气,放出热量624kJ,该反应的热化学方程式是
又知:H2O(g)=H2O(l)ΔH=-44kJ·mol-1,若1mol液态N2H4在O2中完全燃烧生成N2和液态水,则放出的热量为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8kJ·mol-1、-283.0kJ·mol-1和-726.5kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水_____ (填“吸收”或“放出”)的能量是________ kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为___________________ ;
(3)在2L的密闭容器中,合成甲醇反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
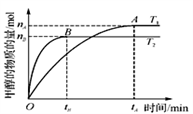
(A、B曲线分别对应T1、T2)
①T1_____ T2(填“>”或“ <”)。
②该反应为_____ 热反应。
③该反应在T1时的平衡常数比T2时的____ (填“大”或“小”)。
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)_____ 。
⑤在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________ 。
(1)用太阳能分解10mol水
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为
(3)在2L的密闭容器中,合成甲醇反应:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
(A、B曲线分别对应T1、T2)
①T1
②该反应为
③该反应在T1时的平衡常数比T2时的
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)
⑤在T1温度时,将1molCO2和3molH2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐3】在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时即产生N2和水蒸气,并放出大量热。已知0.4mol液态肼和足量H2O2反应,生成氮气和水蒸气,放出256kJ的热量。
(1)写出该反应的热化学方程式____ 。
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是__ 。
(3)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=____ kJ·mol-1
(4)用离子方程式表示碳酸钠溶液显碱性的原因:________ 。
(1)写出该反应的热化学方程式
(2)上述反应应用于火箭推进剂,除释放大量的热和快速产生大量气体外,还有一个很突出的优点是
(3)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1
CH3OCH3(g)+H2O(g)===2CH3OH(g) ΔH2=+23.4kJ·mol-1
则2CO2(g)+6H2(g)===CH3OCH3(g)+3H2O(g) ΔH3=
(4)用离子方程式表示碳酸钠溶液显碱性的原因:
您最近一年使用:0次
【推荐1】按要求回答下列各题:
(1)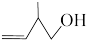 中非含氧官能团的名称是
中非含氧官能团的名称是____ ;含氧官能团的电子式为____ 。
(2) 的系统命名
的系统命名____ 。 的系统命名为
的系统命名为____ 。反-2-丁烯的结构式____ 。
(3)写出葡萄糖的银镜反应方程式:____ 。
(4)2,6-二甲基-4-乙基辛烷的结构简式为____ ,1mol该烃完全燃烧需消耗氧气____ mol。
(5)①C2H5OH②H2CO3溶液③H2O都能与Na反应放出H2,其产生H2速率排列顺序是____ (填入对应的序号)。
(1)
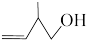 中非含氧官能团的名称是
中非含氧官能团的名称是(2)
 的系统命名
的系统命名 的系统命名为
的系统命名为(3)写出葡萄糖的银镜反应方程式:
(4)2,6-二甲基-4-乙基辛烷的结构简式为
(5)①C2H5OH②H2CO3溶液③H2O都能与Na反应放出H2,其产生H2速率排列顺序是
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
【推荐2】1mol某烃A和1mol苯完全燃烧,在相同条件下,生成 体积相同,烃A比苯多消耗1.5mol
体积相同,烃A比苯多消耗1.5mol ,试回答:
,试回答:
(1)烃A的分子式是___________ 。
(2)若烃A不能使溴水褪色,但在一定条件下能与 发生取代反应,其一氯代物只有一种,则烃A的结构简式为
发生取代反应,其一氯代物只有一种,则烃A的结构简式为___________ ;写出由苯制A的化学方程式___________ 。
(3)若烃A能使溴水褪色,且分子中所有碳原子共平面,则A的结构简式为___________ 。
 体积相同,烃A比苯多消耗1.5mol
体积相同,烃A比苯多消耗1.5mol ,试回答:
,试回答:(1)烃A的分子式是
(2)若烃A不能使溴水褪色,但在一定条件下能与
 发生取代反应,其一氯代物只有一种,则烃A的结构简式为
发生取代反应,其一氯代物只有一种,则烃A的结构简式为(3)若烃A能使溴水褪色,且分子中所有碳原子共平面,则A的结构简式为
您最近一年使用:0次
解答题-有机推断题
|
适中
(0.65)
解题方法
【推荐3】I.下列四种烃分别在氧气中完全燃烧:(填字母序号)
(1)若烃的物质的量相等,则消耗氧气最多的是__________ ;
(2)若烃的质量相等,则消耗氧气最多的是___________ ;
(3)若反应前后(150℃)气体的物质的量不发生变化,则该烃可能是________。
下列各组化合物中,不论二者以什么比例混合,完全燃烧时:
(4)若总质量不变,耗O2量不变的是________ ;
(5)若总质量不变,生成水的质量不变的是______ 。
(6)若总的物质的量不变,则耗O2量不变的是________ ;
(7)若总的物质的量不变,生成CO2的质量不变的是________。
II.标准状况下,1.68 L无色无味的可燃性气体在足量氧气中完全燃烧,若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(8)计算燃烧产物中水的质量为________ 。
(9)若原气体是单一的烃类气体,通过计算推断它的化学式:____________ 。
(10)若原气体是两种等物质的量的气态烃的混合物,请写出它们的结构简式(要求写出一组符合条件的物质的结构简式即可):____________ 。
(1)若烃的物质的量相等,则消耗氧气最多的是
(2)若烃的质量相等,则消耗氧气最多的是
(3)若反应前后(150℃)气体的物质的量不发生变化,则该烃可能是________。
| A.C2H6 | B.C2H4 | C.C4H10 | D.C5H10 |
下列各组化合物中,不论二者以什么比例混合,完全燃烧时:
(4)若总质量不变,耗O2量不变的是
(5)若总质量不变,生成水的质量不变的是
(6)若总的物质的量不变,则耗O2量不变的是
(7)若总的物质的量不变,生成CO2的质量不变的是________。
| A.C2H4、C3H6 | B.HCHO、CH3COOH |
| C.CH4、CH3COOH | D.CH2=CH2、CH3CH2OH |
II.标准状况下,1.68 L无色无味的可燃性气体在足量氧气中完全燃烧,若将产物通入足量澄清石灰水,得到的白色沉淀质量为15.0 g;若用足量碱石灰吸收燃烧产物,增重9.3 g。
(8)计算燃烧产物中水的质量为
(9)若原气体是单一的烃类气体,通过计算推断它的化学式:
(10)若原气体是两种等物质的量的气态烃的混合物,请写出它们的结构简式(要求写出一组符合条件的物质的结构简式即可):
您最近一年使用:0次



