研究化学反应过程与能量变化的关系具有重要意义。回答下列问题:
(1)CO2和NH3合成尿素[CO(NH2)2]的能量变化如图1所示,写出该反应的热化学方程式:____ 。
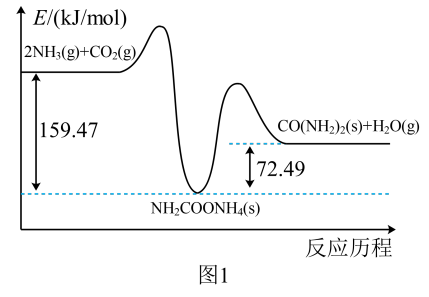
(2)C6H6(l)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以测量,原因是____ 。已知CO的燃烧热,还需要的一组数据是____ (写出热化学方程式,焓变用△H表示)。
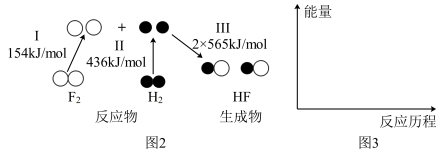
(3)H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图1,在图3中画出该反应的能量一反应历程曲线图(标出该反应的焓变)____ 。
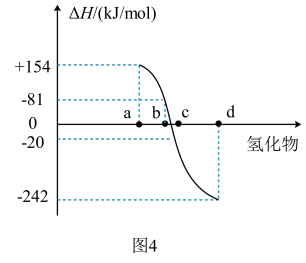
(4)图4表示VIA族的O、S、Se、Te在生成1mol气态氢化物时的焓变数据,根据数据可确定c代表____ (填元素符号)的氢化物,写出H2Te发生分解反应的热化学方程式:____ 。
(5)已知:S8(s)+8O2(g)=8SO2(g) △H=-8akJ•mol-1;1个S8分子中有8个硫硫键,1个SO2分子中有2个硫氧键;破坏1mol硫氧键、1mol氧氧键所需能量分别为bkJ、ckJ,则生成1mol硫硫键所释放能量为____ 。
(1)CO2和NH3合成尿素[CO(NH2)2]的能量变化如图1所示,写出该反应的热化学方程式:

(2)C6H6(l)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以测量,原因是
(3)H2(g)与F2(g)发生反应生成HF(g)过程中的能量变化如图2所示,仿照图1,在图3中画出该反应的能量一反应历程曲线图(标出该反应的焓变)

(4)图4表示VIA族的O、S、Se、Te在生成1mol气态氢化物时的焓变数据,根据数据可确定c代表

(5)已知:S8(s)+8O2(g)=8SO2(g) △H=-8akJ•mol-1;1个S8分子中有8个硫硫键,1个SO2分子中有2个硫氧键;破坏1mol硫氧键、1mol氧氧键所需能量分别为bkJ、ckJ,则生成1mol硫硫键所释放能量为
更新时间:2022-10-12 19:03:00
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示的过程是目前直接利用太阳能的研究热点。人们把通过人工光化学手段合成燃料的过程叫做人工光合作用。

(1)在图构想的物质和能量循环中太阳能最终转化为______ 能;
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g) 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是____________ (填序号);
A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的______ 极(填“正”或“负”),通入氧气一极的电极反应式:_________ 。
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为________________ 。

(1)在图构想的物质和能量循环中太阳能最终转化为
(2)人工光合作用的途径之一就是在催化剂和光照条件下,将CO2和H2O转化为CH3OH(甲醇),该反应的化学方程式为:2CO2(g)+4H2O(g)
 2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是
2CH3OH(g)+3O2(g)。一定条件下,在2 L密闭容器中进行上述反应,下列能说明该反应已达到平衡状态的是A.v正(H2O)=2v逆(CO2) B.n(CH3OH)∶n(O2)=2∶3
C.容器内压强保持不变 D.容器内混合气体密度保持不变
(3)①用人工光合作用得到的甲醇、氧气和稀硫酸制作燃料电池,则甲醇应通入该燃料电池的
②若用氢氧化钾溶液作电解液制成甲醇燃料电池,其负极的电极反应式为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐2】回答下列问题:
I.下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题
(1)下列氢化物中最稳定的是_______ (填标号)。
A.HCl B.HBr C.HI
(2)按照反应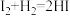 ,生成2 mol HI
,生成2 mol HI____ (填“吸收”或“放出”)的热量为____ kJ。
Ⅱ.某温度时,在一个2 L的密闭容器中, A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据填写下列空白:

(3)该反应的化学方程式为_______ ;
(4)从开始至2min,A的平均反应速率为_______ ;
(5)2min反应达平衡容器内混合气体的平均相对分子质量比起始时_______ (填“大”,“小”或“相等”,下同),混合气体密度比起始时_______ 。
(6)在某一时刻采取下列措施能使该反应速率减小的是_______(填标号)。
I.下表中的数据是破坏1mol物质中的化学键所消耗的能量,回答下列问题
| 物质 | Cl2 | Br2 | I2 | HCl | HBr | HI | H2 |
| 键能/kJ | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
(1)下列氢化物中最稳定的是
A.HCl B.HBr C.HI
(2)按照反应
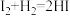 ,生成2 mol HI
,生成2 mol HIⅡ.某温度时,在一个2 L的密闭容器中, A、B、C三种气体物质的浓度随时间的变化曲线如图所示。根据图中数据填写下列空白:

(3)该反应的化学方程式为
(4)从开始至2min,A的平均反应速率为
(5)2min反应达平衡容器内混合气体的平均相对分子质量比起始时
(6)在某一时刻采取下列措施能使该反应速率减小的是_______(填标号)。
| A.加催化剂 | B.降低温度 |
| C.容积不变,充入A | D.容积不变,从容器中分离出A |
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ、反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.

(1)该反应是_________ 反应(填“吸热”、“放热”)。
(2)当反应达到平衡时,升高温度,A的转化率_______ (填“增大”、“减小”、“不变”)。
(3)反应体系中加入催化剂对反应热是否有影响?_____ (填“有”、“无”),原因是____ 。
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1____ (填“增大”、“减小”、“不变”)。
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g) PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
(1)50~150s内的平均反应速率v(PCl3)=___________ 。
(2)该温度下,此反应的化学平衡常数的数值为___________ (可用分数表示)。
(3)反应至250s时,该反应放出的热量为______________ kJ。
(4)下列关于上述反应的说法中,正确的是__________ (填字母序号)。
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线__________ 。

 C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
C(g)+D(g)过程中的能量变化如图所示,回答下列问题.
(1)该反应是
(2)当反应达到平衡时,升高温度,A的转化率
(3)反应体系中加入催化剂对反应热是否有影响?
(4)在反应体系中加入催化剂,反应速率增大,E1的变化是:E1
Ⅱ、五氯化磷(PCl5)是有机合成中重要的氯化剂,可以由三氯化磷(PCl3)氯化得到:PCl3(g)+Cl2(g)
 PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:
PCl5(g) △H=-0.930 kJ•mol-1 。某温度下,在容积恒定为2.0L的密闭容器中充入2.0 mol PCl3和1.0 mol Cl2,一段时间后反应达平衡状态,实验数据如下表所示:| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl5)/mol | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
(1)50~150s内的平均反应速率v(PCl3)=
(2)该温度下,此反应的化学平衡常数的数值为
(3)反应至250s时,该反应放出的热量为
(4)下列关于上述反应的说法中,正确的是
a.无论是否达平衡状态,混合气体的密度始终不变
b.300s时,升高温度,正、逆反应速率同时增大
c.350s时,向该密闭容器中充入氮气,平衡向正反应方向移动
d.相同条件下,若起始向该密闭容器中充入1.0molPCl3和0.5molCl2,达到化学平衡状态时,n(PCl5)<0.20mol
(5)温度T1时,混合气体中PCl5的体积分数随时间t变化的示意图如下。其他条件相同,请在下图中画出温度为T2(T2>T1)时,PCl5的体积分数随时间变化的曲线

您最近一年使用:0次
【推荐1】化学反应过程中都伴随能量变化,吸热或放热是化学反应中能量变化的重要形式。回答下列问题:
(1)化学反应中伴随热量变化的本质原因是反应过程中形成化学键___________ ,断裂化学键___________ 。
(2)已知拆开1mol H—H键、1mol Cl—Cl键、1mol H—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应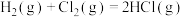 的
的 =
=___________  。
。
(3)已知: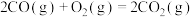
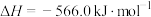 ;
;
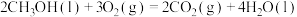
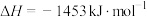 。
。
则 (l)不完全燃烧生成CO和
(l)不完全燃烧生成CO和 (l)的热化学方程式为
(l)的热化学方程式为___________ 。
(4)已知常温常压下,稀的强酸与稀的强碱溶液生成1mol (l)的反应热
(l)的反应热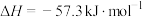 。
。
①表示稀硫酸与稀烧碱溶液生成1mol (l)的热化学方程式为
(l)的热化学方程式为___________ 。
②若用98%浓硫酸代替稀硫酸与稀烧碱溶液进行中和反应反应热测定,则所测得的
___________ (填“偏大”或“偏小”)。
(1)化学反应中伴随热量变化的本质原因是反应过程中形成化学键
(2)已知拆开1mol H—H键、1mol Cl—Cl键、1mol H—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应
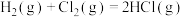 的
的 =
= 。
。(3)已知:
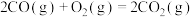
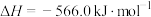 ;
;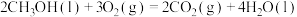
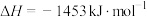 。
。则
 (l)不完全燃烧生成CO和
(l)不完全燃烧生成CO和 (l)的热化学方程式为
(l)的热化学方程式为(4)已知常温常压下,稀的强酸与稀的强碱溶液生成1mol
 (l)的反应热
(l)的反应热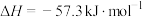 。
。①表示稀硫酸与稀烧碱溶液生成1mol
 (l)的热化学方程式为
(l)的热化学方程式为②若用98%浓硫酸代替稀硫酸与稀烧碱溶液进行中和反应反应热测定,则所测得的

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
解题方法
【推荐2】汽车尾气中含有CO、NO等有毒气体,会危害人体健康。
(1)汽车尾气中NO生成过程的能量变化如图示。 和
和 完全反应生成NO会
完全反应生成NO会___________ (填“吸收”或“放出”)___________ kJ能量。

(2)汽缸内温度越高,单位时间内NO排放量越大的原因是___________ 。
(3)一种新型催化剂用于治理汽车尾气,反应原理为: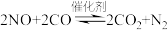 ,一定温度下,在容积固定的容器中发生反应,下列不能说明已达到平衡状态的是
,一定温度下,在容积固定的容器中发生反应,下列不能说明已达到平衡状态的是___________ 。
a.容器内压强不变 b.容器内NO的浓度等于 的浓度
的浓度
c.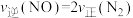 d.容器内混合气体密度保持不变
d.容器内混合气体密度保持不变
(4)某温度下,在两个容积均为1L的恒容密闭容器中,分别充入 和
和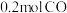 ,在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示:
,在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示:

①与实验Ⅰ相比,实验Ⅱ改变的一种反应条件是___________ 。
②实验Ⅰ从开始至达到平衡时的反应速率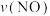 为
为___________ 。
③实验中Ⅱ达平衡时CO的转化率为___________ 。
(1)汽车尾气中NO生成过程的能量变化如图示。
 和
和 完全反应生成NO会
完全反应生成NO会
(2)汽缸内温度越高,单位时间内NO排放量越大的原因是
(3)一种新型催化剂用于治理汽车尾气,反应原理为:
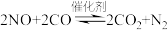 ,一定温度下,在容积固定的容器中发生反应,下列不能说明已达到平衡状态的是
,一定温度下,在容积固定的容器中发生反应,下列不能说明已达到平衡状态的是a.容器内压强不变 b.容器内NO的浓度等于
 的浓度
的浓度c.
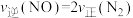 d.容器内混合气体密度保持不变
d.容器内混合气体密度保持不变(4)某温度下,在两个容积均为1L的恒容密闭容器中,分别充入
 和
和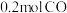 ,在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示:
,在不同条件下进行上述反应,反应体系总压强随时间的变化如图所示:
①与实验Ⅰ相比,实验Ⅱ改变的一种反应条件是
②实验Ⅰ从开始至达到平衡时的反应速率
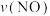 为
为③实验中Ⅱ达平衡时CO的转化率为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】Ⅰ.完成下列问题。
(1)一定温度下,向容积为 的密闭容器中通入
的密闭容器中通入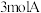 和
和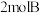 ,混合气体起始压强为
,混合气体起始压强为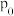 。发生如下反应:
。发生如下反应: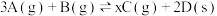 ,反应进行到
,反应进行到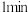 时测得剩余
时测得剩余 ,此时
,此时 的浓度为
的浓度为 。反应进行到
。反应进行到 时该容器内混合气体总压强为
时该容器内混合气体总压强为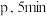 后反应达到平衡。
后反应达到平衡。
① 为
为___________ 。
②请用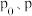 来表示
来表示 时反应物
时反应物 的转化率为
的转化率为___________  。
。
③在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是___________ 。
A. ; B.
; B.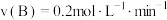 ;
;
C.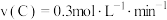 ; D.
; D.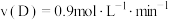 ;
;
(2)已知: ,不同温度
,不同温度 下,
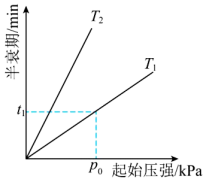
下, 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
_________  (填“>”、“=”或“<”)。当温度为
(填“>”、“=”或“<”)。当温度为 、起始压强为
、起始压强为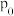 ,反应至
,反应至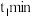 时,此时体系压强
时,此时体系压强
________ (用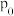 表示)。
表示)。
Ⅱ.将一定量纯净的氨基甲酸铵( )置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: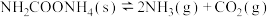 。
。
(3)下列能说明该分解反应已经达到化学平衡状态的是___________ (填字母)。
A.密闭容器中 的体积分数保持不变
的体积分数保持不变
B.密闭容器中气体的总物质的量不变
C.容器中 与
与 的物质的量之比保持不变
的物质的量之比保持不变
D.密闭容器中总压强保持不变
E.密闭容器中混合气体的平均相对分子质量保持不变
(4)能使该反应的反应速率增大的是___________(填字母)。
(5)如图所示,上述反应中断开反应物中化学键吸收的能量___________ 形成生成物中化学键放出的能量(填“大于”“等于”或“小于”)。

(1)一定温度下,向容积为
 的密闭容器中通入
的密闭容器中通入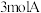 和
和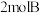 ,混合气体起始压强为
,混合气体起始压强为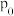 。发生如下反应:
。发生如下反应: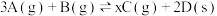 ,反应进行到
,反应进行到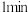 时测得剩余
时测得剩余 ,此时
,此时 的浓度为
的浓度为 。反应进行到
。反应进行到 时该容器内混合气体总压强为
时该容器内混合气体总压强为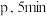 后反应达到平衡。
后反应达到平衡。①
 为
为②请用
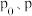 来表示
来表示 时反应物
时反应物 的转化率为
的转化率为 。
。③在四种不同的条件下测定得到以下反应速率,其中表示的反应速率最快的是
A.
 ; B.
; B.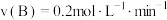 ;
;C.
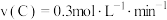 ; D.
; D.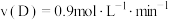 ;
;(2)已知:
 ,不同温度
,不同温度 下,
下, 分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度
分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度 消耗一半时所需的相应时间),则
消耗一半时所需的相应时间),则
 (填“>”、“=”或“<”)。当温度为
(填“>”、“=”或“<”)。当温度为 、起始压强为
、起始压强为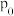 ,反应至
,反应至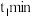 时,此时体系压强
时,此时体系压强
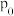 表示)。
表示)。Ⅱ.将一定量纯净的氨基甲酸铵(
 )置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:
)置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡: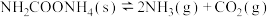 。
。
(3)下列能说明该分解反应已经达到化学平衡状态的是
A.密闭容器中
 的体积分数保持不变
的体积分数保持不变B.密闭容器中气体的总物质的量不变
C.容器中
 与
与 的物质的量之比保持不变
的物质的量之比保持不变D.密闭容器中总压强保持不变
E.密闭容器中混合气体的平均相对分子质量保持不变
(4)能使该反应的反应速率增大的是___________(填字母)。
A.及时分离出 气体 气体 | B.适当升高温度 |
C.加入少量 | D.选择高效催化剂 |

您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐1】AlN新型材料应用前景广泛,其制备与性质研究成为热点。
相关数据如下:
(1)AlN的制备。
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是____________________ 。
Ⅱ.上述反应适宜的温度范围是______ ℃(填字母)。
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:__________________ 、_________ 和2Al + N2  2AlN。
2AlN。
③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:______________________________________ 。
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。
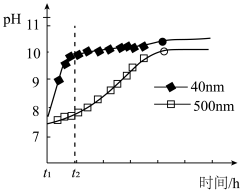
① AlN粉末水解的化学方程式是____________________________________ 。
② 解释t1-t2时间内两条曲线差异的可能原因:_______________________________ 。
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是________________________________ 。
相关数据如下:
| 物质 | 熔点/℃ | 沸点/℃ | 与N2反应温度/℃ | 相应化合物分解温度/℃ |
| Al | 660 | 2467 | >800 | AlN:>2000 (>1400升华) AlCl3:(>181升华) |
| Mg | 649 | 1090 | >300 | Mg3N2:>800 |
① 化学气相沉积法。
Ⅰ.一定温度下,以AlCl3气体和NH3为原料制备AlN,反应的化学方程式是
Ⅱ.上述反应适宜的温度范围是
a.75~100 b.600~1100 c.2000~2300
② 铝粉直接氮化法。
Al与N2可直接化合为AlN固体,AlN能将Al包裹,反应难以继续进行。控制温度,在Al粉中均匀掺入适量Mg粉,可使Al几乎全部转化为AlN固体。该过程发生的反应有:
 2AlN。
2AlN。③碳热还原法。
以Al2O3、C(石墨)和N2为原料,在高温下制备AlN。
已知:ⅰ. 2Al2O3(s) ⇌ 4Al(g) + 3O2(g) ∆H 1 =+3351 kJ·mol-1
ⅱ. 2C(石墨,s) + O2(g) = 2CO(g) ∆H 2 =-221 kJ·mol-1
ⅲ. 2Al(g) + N2(g) = 2AlN(s) ∆H 3 =-318 kJ·mol-1
运用平衡移动原理分析反应ⅱ对反应ⅰ的可能影响:
(2)AlN的性质。AlN粉末可发生水解。相同条件下,不同粒径的AlN粉末水解时溶液pH的变化如图所示。

① AlN粉末水解的化学方程式是
② 解释t1-t2时间内两条曲线差异的可能原因:
(3)AlN含量检测。向a g AlN样品中加入足量浓NaOH溶液,然后通入水蒸气将NH3全部蒸出,将NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余的H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则样品中AlN的质量分数是
您最近一年使用:0次
【推荐2】二甲醚(CH3OCH3)具有优良的燃烧性能,被称为21世纪的“清洁能源”。一步法合成二甲醚是以合成气(CO/H2)为原料,在一定温度、压强和催化剂作用下进行,反应器中发生了下列反应:
①CO(g)+2H2(g) CH3OH(g) △H1=-90.7kJ•mol-1
CH3OH(g) △H1=-90.7kJ•mol-1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1
③CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.2kJ•mol-1
CO2(g)+H2(g) △H3=-41.2kJ•mol-1
(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g) CH3OCH3(g)+3H2O(g),该反应的△H=
CH3OCH3(g)+3H2O(g),该反应的△H=___ kJ•mol-1;
判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为达到化学平衡状态的依据是___ 。
A.平均摩尔质量保持不变
B.容器的密度不变
C.容器内压强保持不变
D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(2)可采用CO和二甲醚催化合成乙醇。
反应①:CH3OCH3(g)+CO(g) CH3COOCH3(g) △H1
CH3COOCH3(g) △H1
反应②:CH3COOCH3(g)+2H2(g) CH3OH(g)+ C2H5OH(g) △H2
CH3OH(g)+ C2H5OH(g) △H2
a.压强为pKpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则△H1____ (填“>”或“<”)0。

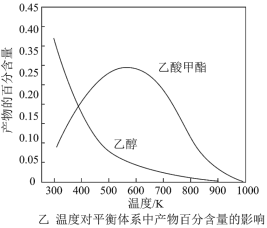
b.温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:___ 。
c.若压强为pKpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为___ ,该条件下反应①的平衡常数K=___ 。
(3)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是___ 极,电解时阳极的电极反应式为___ 。

①CO(g)+2H2(g)
 CH3OH(g) △H1=-90.7kJ•mol-1
CH3OH(g) △H1=-90.7kJ•mol-1②2CH3OH(g)
 CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1
CH3OCH3(g)+H2O(g) △H2=-23.5kJ•mol-1③CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.2kJ•mol-1
CO2(g)+H2(g) △H3=-41.2kJ•mol-1(1)一种新合成二甲醚的方法为一定条件下:2CO2(g)+6H2(g)
 CH3OCH3(g)+3H2O(g),该反应的△H=
CH3OCH3(g)+3H2O(g),该反应的△H=判断该反应在一定温度下、体积恒定的密闭容器中,下列不能作为达到化学平衡状态的依据是
A.平均摩尔质量保持不变
B.容器的密度不变
C.容器内压强保持不变
D.单位时间内消耗2molCO2,同时消耗1mol二甲醚
(2)可采用CO和二甲醚催化合成乙醇。
反应①:CH3OCH3(g)+CO(g)
 CH3COOCH3(g) △H1
CH3COOCH3(g) △H1反应②:CH3COOCH3(g)+2H2(g)
 CH3OH(g)+ C2H5OH(g) △H2
CH3OH(g)+ C2H5OH(g) △H2a.压强为pKpa时,温度对二甲醚和乙酸甲酯平衡转化率的影响如图甲所示,则△H1


b.温度对平衡体系中乙酸甲酯的含量和乙醇的影响如图乙所示,在300~600K范围内,乙酸甲酯的含量逐渐增大,而乙醇的百分含量逐渐减小的原因是:
c.若压强为pKpa、温度为800K时,向2L恒容密闭容器中充入1molCH3OCH3和1molCO发生反应①,2min时达到平衡,则前2min内CH3COOCH3的平均生成速率为
(3)以铜为原料,利用电解法可制取具有广泛用途的光电材料——纳米Cu2O,其工作原理如图3所示。则b是

您最近一年使用:0次
【推荐3】已知汽车尾气排放时容易发生以下反应:
Ⅰ.N2(g)+O2(g) 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1
Ⅱ.2CO(g)+2NO(g) N2(g)+2CO2(g) ΔH2
N2(g)+2CO2(g) ΔH2
请回答下列问题:
(1)若CO的燃烧热(ΔH3)为-283.5 kJ·mol-1,则反应Ⅱ的ΔH2=_______ kJ·mol-1。
(2)若在恒容密闭容器中充入2 mol CO(g)和1 mol NO(g),发生反应Ⅱ,下列选项中不能说明反应已达到平衡状态的是_______ (填标号)。
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(N2)=2v逆(CO)
(3)CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g) N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
①0~5 min内,v正(CO2)=_______ mol·L-1·min-1;该温度下反应的化学平衡常数K=_______ (保留两位有效数字)L·mol-1。
②其他条件不变,升高温度,NO2的平衡转化率_______ (填“增大”、“减小”或“不变”,下同),混合气体的密度_______ 。
③20 min时,保持温度、压强不变,将容器改为恒温恒压密闭容器,再向容器中通入0.4 mol CO、0.7 mol N2和0.4 mol CO2,此时v正_______ v逆(填“>”“<”或“=”)。
Ⅰ.N2(g)+O2(g)
 2NO(g) ΔH1=+180 kJ·mol-1
2NO(g) ΔH1=+180 kJ·mol-1Ⅱ.2CO(g)+2NO(g)
 N2(g)+2CO2(g) ΔH2
N2(g)+2CO2(g) ΔH2请回答下列问题:
(1)若CO的燃烧热(ΔH3)为-283.5 kJ·mol-1,则反应Ⅱ的ΔH2=
(2)若在恒容密闭容器中充入2 mol CO(g)和1 mol NO(g),发生反应Ⅱ,下列选项中不能说明反应已达到平衡状态的是
A.CO和NO的物质的量之比不变
B.混合气体的密度保持不变
C.混合气体的压强保持不变
D.v正(N2)=2v逆(CO)
(3)CO和NO2也可发生类似于反应Ⅱ的变化,热化学方程式为2NO2(g)+4CO(g)
 N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:
N2(g)+4CO2(g) ΔH4<0.一定温度下,向2 L恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,测得相关数据如下:| 0 min | 5 min | 10 min | 15 min | 20 min | |
| c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
| c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
②其他条件不变,升高温度,NO2的平衡转化率
③20 min时,保持温度、压强不变,将容器改为恒温恒压密闭容器,再向容器中通入0.4 mol CO、0.7 mol N2和0.4 mol CO2,此时v正
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
【推荐1】I.回答下列问题。
(1)汽车发动机工作时会引发 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如图所示,图中对应反应的热化学方程式为
等污染大气,其中生成NO的能量变化如图所示,图中对应反应的热化学方程式为_______ 。

(2)下图是 与CO反应转化为
与CO反应转化为 和NO过程中的能量变化示意图,该反应的活化能为
和NO过程中的能量变化示意图,该反应的活化能为_______ kJ/mol。根据图分析,若0.5molCO被氧化,该过程放出的热量Q=_______ kJ。若该反应是可逆反应,在相同条件下将0.5molCO与1mol 混合,则充分反应后放出的热量
混合,则充分反应后放出的热量_______ (填“>”“<”或“=”)QkJ。

Ⅱ.化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式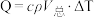 计算获得。
计算获得。
(3)热量的测定:取 NaOH和
NaOH和 盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为
盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为 、
、 ,则该过程放出的热量为
,则该过程放出的热量为_______ J(c和 分别取
分别取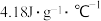 和
和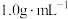 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。
(4)甲同学测量放热反应 的焓变
的焓变 (忽略温度对焓变的影响,下同)。实验结果见下表。
(忽略温度对焓变的影响,下同)。实验结果见下表。
①温度:b_______ c(填“>”“<”或“=”)。
②
_______ (选择表中一组数据计算)。结果表明,该方法可行。
(5)化学能可转化为热能,写出其在生产或生活中的一种应用_______ 。
(1)汽车发动机工作时会引发
 和
和 反应,生成
反应,生成 等污染大气,其中生成NO的能量变化如图所示,图中对应反应的热化学方程式为
等污染大气,其中生成NO的能量变化如图所示,图中对应反应的热化学方程式为
(2)下图是
 与CO反应转化为
与CO反应转化为 和NO过程中的能量变化示意图,该反应的活化能为
和NO过程中的能量变化示意图,该反应的活化能为 混合,则充分反应后放出的热量
混合,则充分反应后放出的热量
Ⅱ.化学反应常伴随热效应。某些反应(如中和反应)的热量变化,其数值Q可通过量热装置测量反应前后体系温度变化,用公式
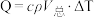 计算获得。
计算获得。(3)热量的测定:取
 NaOH和
NaOH和 盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为
盐酸各50mL进行反应,测得反应前后体系的温度值(℃)分别为 、
、 ,则该过程放出的热量为
,则该过程放出的热量为 分别取
分别取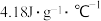 和
和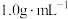 ,忽略水以外各物质吸收的热量,下同)。
,忽略水以外各物质吸收的热量,下同)。(4)甲同学测量放热反应
 的焓变
的焓变 (忽略温度对焓变的影响,下同)。实验结果见下表。
(忽略温度对焓变的影响,下同)。实验结果见下表。| 序号 | 反应试剂 | 体系温度/℃ | ||
| 反应前 | 反应后 | |||
| i | 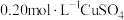 溶液100mL 溶液100mL | 1.20gFe粉 | a | b |
| ii | 0.56gFe粉 | a | c | |
②

(5)化学能可转化为热能,写出其在生产或生活中的一种应用
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇:CO2(g)+3H2(g) CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:

(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量________ (填“大于”“小于”或“等于”)形成生成物中的化学键释放的总能量。
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:______ 。甲醇分子中的化学键类型是____ (填“离子键”或“共价键”)。
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是________ ,发生的是________ (填“氧化”或“还原”)反应。
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:_______ 。
(5)下列事实能表明该反应已达平衡状态的是________ (填序号)。
A. CO2(g)的浓度不再发生变化
B. 单位时间内消耗1mol CO2的同时生成3mol H2
C. 在一个绝热的容器中,混合物的温度不再发生变化
D. 在一个容积固定的容器内,压强不再发生变化
 CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:
CH3OH(g)+H2O(g)。该反应进行过程中能量的变化(单位为kJ·mol-1)如图所示。请回答下列问题:
(1)观察图象可知上述反应过程中,断裂反应物中的化学键吸收的总能量
(2)甲醇的结构类似于乙醇,试写出甲醇的结构式:
(3)科研人员开发出一种新型甲醇燃料电池。其电解质溶液是KOH溶液,在该电池的负极发生反应的物质是
(4)欲使合成甲醇的化学反应速率加快,请写出两条措施:
(5)下列事实能表明该反应已达平衡状态的是
A. CO2(g)的浓度不再发生变化
B. 单位时间内消耗1mol CO2的同时生成3mol H2
C. 在一个绝热的容器中,混合物的温度不再发生变化
D. 在一个容积固定的容器内,压强不再发生变化
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:_______ 。
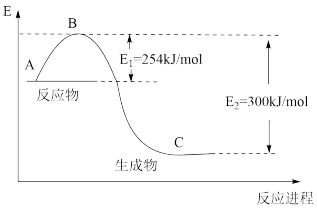
(2)若已知表中数据:
试根据表中及图中数据计算N-H的键能:_______ kJ·mol-1。
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:_______ 。
(4)N、H、O元素形成的离子化合物为_______ (填化学式)。
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。
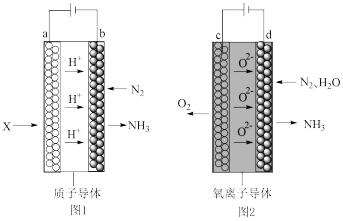
图1中,a 电极上通入的X 为_______ ;图 2 中,d 电极上的电极反应式为_______ 。
(1)图是N2(g)和H2(g)反应生成1molNH3(g)过程中能量的变化示意图,请写出N2和H2反应的热化学方程式:

(2)若已知表中数据:
| 化学键 | H-H | N≡N |
| 键能/kJ·mol-1 | 435 | 943 |
试根据表中及图中数据计算N-H的键能:
(3)用NH3催化还原NOx还可以消除氮氧化物的污染。
已知:①4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1=-akJ·mol-1
② N2(g)+O2(g)=2NO(g) ΔH2=-bkJ·mol-1
则NH3还原NO的热化学方程式:
(4)N、H、O元素形成的离子化合物为
(5) 氨气可用电解法合成,其原料转化率大幅度提高,有望代替传统的工业合成氨工艺。电解法合成氨的两种原理及装置如图1和图2所示。

图1中,a 电极上通入的X 为
您最近一年使用:0次



