环丙烷(△)与丙烷(CH3CH2CH3)都是重要的化学燃料,已知: ,环丙烷(g)的燃烧热
,环丙烷(g)的燃烧热 ,丙烷(g)的燃烧热
,丙烷(g)的燃烧热 ,1mol液态水蒸发为气态水的焓变为
,1mol液态水蒸发为气态水的焓变为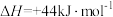 。则2mol氢气完全燃烧生成气态水的
。则2mol氢气完全燃烧生成气态水的 (kJ/mol)为
(kJ/mol)为
 ,环丙烷(g)的燃烧热
,环丙烷(g)的燃烧热 ,丙烷(g)的燃烧热
,丙烷(g)的燃烧热 ,1mol液态水蒸发为气态水的焓变为
,1mol液态水蒸发为气态水的焓变为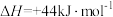 。则2mol氢气完全燃烧生成气态水的
。则2mol氢气完全燃烧生成气态水的 (kJ/mol)为
(kJ/mol)为| A.-658 | B.-482 | C.-329 | D.-285 |
更新时间:2022-11-05 20:24:01
|
【知识点】 盖斯定律与热化学方程式解读
相似题推荐
单选题
|
适中
(0.65)
【推荐1】已知:2CO(g)+O2(g)=2CO2(g) △H=-566kJ/mol Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g) △H=-226kJ/mol。根据以上热化学方程式判断,下列说法正确的是
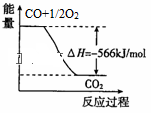

| A.CO的燃烧热为566kJ/mol |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H>-452kJ/mol |
| D.CO2 (g)与Na2O2(s)反应放出452kJ热量时,转移电子个数为6.02×1023 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】工业上利用两种温室气体CH4和CO2催化重整制H2和CO,主要反应为:
反应I:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH=247.4kJ·mol-1,
过程中还发生三个副反应:
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=41.2kJ·mol-1;
反应III:2CO(g)⇌CO2(g)+C(s) ΔH=-171.0kJ·mol-1;
反应IV:CH4(g)⇌2H2(g)+C(s) ΔH;
将CH4与CO2(体积比为1∶1)的混合气以一定流速通过催化剂,产物中H2与CO的物质的量之比、CO2的转化率与温度的关系如图所示。下列说法正确的是

反应I:CH4(g)+CO2(g)⇌2CO(g)+2H2(g) ΔH=247.4kJ·mol-1,
过程中还发生三个副反应:
反应II:CO2(g)+H2(g)⇌CO(g)+H2O(g) ΔH=41.2kJ·mol-1;
反应III:2CO(g)⇌CO2(g)+C(s) ΔH=-171.0kJ·mol-1;
反应IV:CH4(g)⇌2H2(g)+C(s) ΔH;
将CH4与CO2(体积比为1∶1)的混合气以一定流速通过催化剂,产物中H2与CO的物质的量之比、CO2的转化率与温度的关系如图所示。下列说法正确的是

| A.反应IV的ΔH=76.4kJ·mol-1 |
| B.升高温度,CO2的转化率增大,一定是因为反应I、II的平衡正向移动 |
| C.升高温度,CO2的转化率增大,一定是因为反应III的速率减慢 |
| D.升高温度,产物中H2与CO的物质的量之比增大,是由于升温有利于反应II正向进行、反应III逆向进行 |
您最近一年使用:0次



