水煤合成气的生产和应用在化学工业中有极为重要的地位。回答下列问题:
(1)利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,可能发生的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-63 kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知部分化学键键能数据如下表:
则ΔH3=_______ kJ•mol-1。
(2)CO2和CH4在一定条件下反应也可制得合成水煤气。在1.0 L密闭容器中充入1.0 mol CH4和1.0 mol CO2,在一定条件下发生反应CH4(g)+CO2(g) 2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
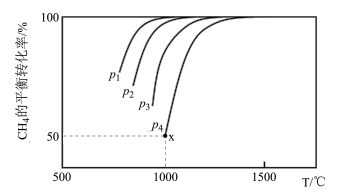
①比较压强大小:p1_______ p3(选填“>”、“<”或“=”)。
②若要提高CH4的平衡转化率,可采取的措施有_______ ,_______ 。(任写两条)
③若p4=2.0 MPa,则x点的平衡常数Kp=_______ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)化学家利用电化学原理回收CO2达到节能减排的目的,有一种实验设计的装置如下图所示。
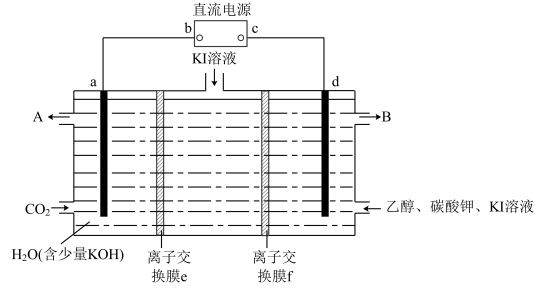
已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛。实验一段时间后,测得a电极周围有甲酸根离子HCOO-生成。回答:
①电极b为_______ 极;
②电解时a电极附近溶液的pH_______ (选填“降低”、“升高”、“不变”);
③e为_______ 交换膜;
④d电极周围除了发生电极反应外,还有_______ (用离子方程式表示)。
(1)利用合成气(主要成分CO、CO2和H2)在催化剂作用下合成甲醇,可能发生的反应有:
①CO2(g)+3H2(g)=CH3OH(g)+H2O(g) ΔH1=-63 kJ•mol-1
②CO2(g)+H2(g)=CO(g)+H2O(g) ΔH2
③CH3OH(g)=CO(g)+2H2(g) ΔH3
已知部分化学键键能数据如下表:
| 化学键 | H-H | C=O | C≡O | O-H |
| 键能(kJ•mol-1) | 436 | 803 | 1076 | 465 |
(2)CO2和CH4在一定条件下反应也可制得合成水煤气。在1.0 L密闭容器中充入1.0 mol CH4和1.0 mol CO2,在一定条件下发生反应CH4(g)+CO2(g)
 2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
2CO(g)+2H2,测得CH4的平衡转化率与温度及压强的关系如下图所示。
①比较压强大小:p1
②若要提高CH4的平衡转化率,可采取的措施有
③若p4=2.0 MPa,则x点的平衡常数Kp=
(3)化学家利用电化学原理回收CO2达到节能减排的目的,有一种实验设计的装置如下图所示。

已知在碱性条件下,卤素单质可以将乙醇氧化为乙醛。实验一段时间后,测得a电极周围有甲酸根离子HCOO-生成。回答:
①电极b为
②电解时a电极附近溶液的pH
③e为
④d电极周围除了发生电极反应外,还有
更新时间:2022-11-05 17:42:07
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
适中
(0.65)
名校
【推荐1】全球大气CO2浓度升高对人类生产生活产生了影响,研究二氧化碳的回收对我国2060年实现碳中和具有现实意义,碳及其化合物的资源化利用成为研究热点。回答下列问题:
(1)已知25℃时,大气中的CO2溶于水存在以下过程:
①CO2(g) CO2(aq)
CO2(aq)
②CO2(aq)+H2O(l) H+(aq)+
H+(aq)+  (aq) K
(aq) K
溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol•L-1•kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为_____ mol•L-1(忽略 和水的电离)。
和水的电离)。
(2)已知CH4的生成焓(由稳定单质生成该物质)为△H=-71.7kJ•mol-1
反应I:C(s)+H2O(g) CO(g)+H2(g) △H1=+131.3kJ•mol-1 K1
CO(g)+H2(g) △H1=+131.3kJ•mol-1 K1
反应II:C(s)+2H2O(g) CO2(g)+2H2(g) △H2=+90.3kJ•mol-1 K2
CO2(g)+2H2(g) △H2=+90.3kJ•mol-1 K2
反应III:CO(g)+H2O(g) CO2(g)+H2(g) △H3=-41.0kJ•mol-1 K3
CO2(g)+H2(g) △H3=-41.0kJ•mol-1 K3
①写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:_____ 。
②研究表明,反应III的速率方程为v=k[x(CO)x(H2O)-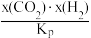 ],x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示,根据速率方程分析T>Tm时,v逐渐下降的原因是
],x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示,根据速率方程分析T>Tm时,v逐渐下降的原因是_____ 。

(3)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:2CO2(g)+6H2(g) CH3CH2OH(g)+3H2O(g) △H。
CH3CH2OH(g)+3H2O(g) △H。
①通过表格中的数值可以推断:该反应在______ (填“高温”、“低温”或“任何温度”)下能自发进行。
②CO2的平衡转化率与氢碳比m[m=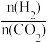 ]及压强、温度的关系分别如图a和图b所示。
]及压强、温度的关系分别如图a和图b所示。

图a中氢碳比m从大到小的顺序为______ 。
图b中压强从大到小的顺序为_____ ,判断依据为______ 。
(1)已知25℃时,大气中的CO2溶于水存在以下过程:
①CO2(g)
 CO2(aq)
CO2(aq)②CO2(aq)+H2O(l)
 H+(aq)+
H+(aq)+  (aq) K
(aq) K溶液中CO2的浓度与其在大气中的分压(分压=总压×物质的量分数)成正比,比例系数为ymol•L-1•kPa-1。当大气压强为pkPa,大气中CO2(g)的物质的量分数为x时,溶液中H+的浓度为
 和水的电离)。
和水的电离)。(2)已知CH4的生成焓(由稳定单质生成该物质)为△H=-71.7kJ•mol-1
反应I:C(s)+H2O(g)
 CO(g)+H2(g) △H1=+131.3kJ•mol-1 K1
CO(g)+H2(g) △H1=+131.3kJ•mol-1 K1反应II:C(s)+2H2O(g)
 CO2(g)+2H2(g) △H2=+90.3kJ•mol-1 K2
CO2(g)+2H2(g) △H2=+90.3kJ•mol-1 K2反应III:CO(g)+H2O(g)
 CO2(g)+H2(g) △H3=-41.0kJ•mol-1 K3
CO2(g)+H2(g) △H3=-41.0kJ•mol-1 K3①写出CO2与H2反应生成CH4和H2O(g)的热化学方程式:
②研究表明,反应III的速率方程为v=k[x(CO)x(H2O)-
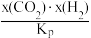 ],x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示,根据速率方程分析T>Tm时,v逐渐下降的原因是
],x表示相应气体的物质的量分数,Kp为平衡常数(用平衡分压代替平衡浓度计算),k为反应的速率常数。在气体物质的量分数和催化剂一定的情况下,反应速率随温度的变化如图所示,根据速率方程分析T>Tm时,v逐渐下降的原因是
(3)工业上用二氧化碳催化加氢可合成乙醇,其反应原理为:2CO2(g)+6H2(g)
 CH3CH2OH(g)+3H2O(g) △H。
CH3CH2OH(g)+3H2O(g) △H。| 温度/K | 400 | 500 |
| 平衡常数K | 9 | 5.3 |
②CO2的平衡转化率与氢碳比m[m=
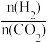 ]及压强、温度的关系分别如图a和图b所示。
]及压强、温度的关系分别如图a和图b所示。
图a中氢碳比m从大到小的顺序为
图b中压强从大到小的顺序为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】回收利用硫和氮的氧化物是环境保护的重要举措。
(1)已知:2NO(g ) + O2(g) 2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:
第一步:2NO(g ) N2O2(g) △H1 =-a kJ•molˉ1(快反应)
N2O2(g) △H1 =-a kJ•molˉ1(快反应)
第二步:N2O2(g ) + O2(g) 2NO2(g) △H2 =-b kJ•molˉ1(慢反应)
2NO2(g) △H2 =-b kJ•molˉ1(慢反应)
①下列对上述反应过程表述正确的是__________ (填标号)。
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为_______________ 。
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g) 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
①与实验a相比,实验b改变的实验条件可能是______________________ 。
②实验b中的平衡转化率a(SO2)=_________ 。
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:

①曲线c对应NH3与NO 的物质的量之比是_______________ 。
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为_____________ mg/(m3•s)。
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液 Na2SO3溶液
Na2SO3溶液
①用化学方程式表示NaOH 再生的原理____________________________________ 。
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为_____________ (已知25℃时,H2SO3的电离平衡常数Ka1=1×10-2,Ka2=1×10-7)。
(1)已知:2NO(g ) + O2(g)
 2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:
2NO2(g),正反应的活化能为c kJ•molˉ1。该反应历程为:第一步:2NO(g )
 N2O2(g) △H1 =-a kJ•molˉ1(快反应)
N2O2(g) △H1 =-a kJ•molˉ1(快反应)第二步:N2O2(g ) + O2(g)
 2NO2(g) △H2 =-b kJ•molˉ1(慢反应)
2NO2(g) △H2 =-b kJ•molˉ1(慢反应)①下列对上述反应过程表述正确的是
A.NO比N2O2稳定
B.该化学反应的速率主要由第二步决定
C.N2O2为该反应的中间产物
D.在一定条件下N2O2的浓度为0时反应达到平衡
②该反应逆反应的活化能为
(2)通过下列反应可从燃煤烟气中回收硫。2CO(g) + 2SO2(g)
 2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示:
2CO2(g) + S(l) △H﹤0,在模拟回收硫的实验中,向某恒容密闭容器通入2.8 mol CO和1 molSO2,反应在不同条件下进行,反应体系总压强随时间的变化如图所示: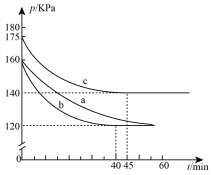
①与实验a相比,实验b改变的实验条件可能是
②实验b中的平衡转化率a(SO2)=
(3)用NH3消除NO污染的反应原理为: 4NH3 + 6NO
 5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
5N2 + 6H2O。不同温度条件下,NH3与NO的物质的量之比分别为 3:1、2:1、1:1 时,得到 NO 脱除率曲线如图所示:
①曲线c对应NH3与NO 的物质的量之比是
②曲线a中 NO的起始浓度为4×10-4 mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为
(4)双碱法除去SO2是指:用 NaOH 吸收SO2,并用CaO使 NaOH再生。NaOH溶液
 Na2SO3溶液
Na2SO3溶液①用化学方程式表示NaOH 再生的原理
②25℃ 时,将一定量的SO2通入到NaOH溶液中,两者完全反应,得到含Na2SO3、 NaHSO3的混合溶液,且溶液恰好呈中性,则该混合溶液中各离子浓度由大到小的顺序为
您最近半年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
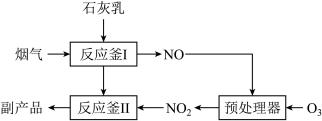
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是_____ 。
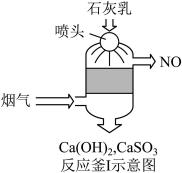
②反应釜II中CaSO3转化为CaSO4的化学反应方程式为_____ 。
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是____ 。

(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是_____ 。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是______ 。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____ 。
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:_____ 。

(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。

①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是

②反应釜II中CaSO3转化为CaSO4的化学反应方程式为
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是

(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)⇌2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:

您最近半年使用:0次



