下列关于碰撞理论解释化学反应速率的有关说法正确的是。
| A.增大反应物浓度能够增大单位体积内活化分子数目,化学反应速率增大 |
| B.升高温度,降低了反应的活化能,活化分子百分数增大,反应速率增大 |
| C.增大压强(减小容器体积),活化分子的百分数增大,化学反应速率增大 |
| D.选用适当的催化剂,反应物分子的能量增加,增加了碰撞频率,反应速率增大 |
更新时间:2022-11-16 13:37:03
|
相似题推荐
单选题
|
适中
(0.65)
名校
【推荐1】 、
、 可用于合成甲醚(CH3OCH3)和甲醇(CH3OH),共反应为(a、b均小于0):
可用于合成甲醚(CH3OCH3)和甲醇(CH3OH),共反应为(a、b均小于0):
反应①: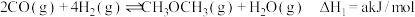
反应②: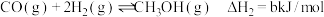
反应③: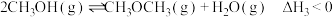
若反应③正反应的活化能为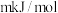 ,则下列说法正确的是
,则下列说法正确的是
 、
、 可用于合成甲醚(CH3OCH3)和甲醇(CH3OH),共反应为(a、b均小于0):
可用于合成甲醚(CH3OCH3)和甲醇(CH3OH),共反应为(a、b均小于0):反应①:
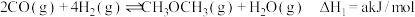
反应②:
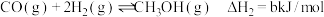
反应③:
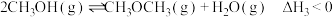
若反应③正反应的活化能为
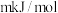 ,则下列说法正确的是
,则下列说法正确的是A. |
B.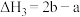 |
C.反应③逆反应的活化能为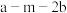 |
| D.将容器体积压缩,活化分子百分比增大,正、逆反应速率均增大 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐2】已知反应:2NO(g)+Br2(g) 2NOBr(g) △H =-a kJ·mol-1(a>0),其反应机理如下:
2NOBr(g) △H =-a kJ·mol-1(a>0),其反应机理如下:
①NO(g)+Br2(g) NOBr2 (g) 快
NOBr2 (g) 快
②NO(g)+NOBr2(g) 2NOBr(g) 慢
2NOBr(g) 慢
下列有关该反应的说法正确的是
 2NOBr(g) △H =-a kJ·mol-1(a>0),其反应机理如下:
2NOBr(g) △H =-a kJ·mol-1(a>0),其反应机理如下:①NO(g)+Br2(g)
 NOBr2 (g) 快
NOBr2 (g) 快 ②NO(g)+NOBr2(g)
 2NOBr(g) 慢
2NOBr(g) 慢下列有关该反应的说法正确的是
| A.该反应的速率主要取决于①的快慢 |
| B.NOBr2是该反应的催化剂 |
| C.慢反应②的活化能小于快反应的活化能 |
| D.正反应的活化能比逆反应的活化能小a kJ·mol-1 |
您最近一年使用:0次
单选题
|
适中
(0.65)
名校
【推荐3】2SO2(g)+O2(g) 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
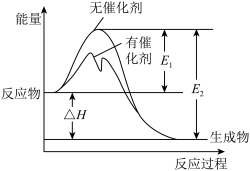
 2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
2SO3(g)反应过程中的能量变化如图所示(图中E1表示无催化剂时正反应的活化能,E2表示无催化剂时逆反应的活化能)。下列有关叙述不正确的是
| A.该反应的逆反应为吸热反应,升高温度可提高活化分子的百分数 |
| B.ΔH=E1-E2,使用催化剂改变活化能,但不改变反应热 |
| C.该反应中,反应物的总键能小于生成物的总键能 |
D.500℃、101kPa下,将1molSO2(g)和0.5molO2(g)置于密闭容器中充分反应生成SO3(g)放热akJ,其热化学方程式为2SO2(g)+O2(g) 2SO3(g) ΔH=-2a kJ·mol-l 2SO3(g) ΔH=-2a kJ·mol-l |
您最近一年使用:0次



