Ⅰ.完成下列问题
(1)用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入1-2滴甲基橙溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2~3次。
以上步骤有错误的是_______ (填编号)。
(2)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,丙为0.1mol/L的 溶液,某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,选用酚酞作指示剂,得到如图所示两条滴定曲线。
溶液,某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,选用酚酞作指示剂,得到如图所示两条滴定曲线。

①甲溶液滴定丙溶液的曲线是_______ (填“图1”或“图2”);
②a=_______ 。
Ⅱ.摩尔盐[ ]是一种重要的化工原料,在定量分析、冶金等方面有重要应用。称取mg摩尔盐配置成100mL溶液。用移液管移取20mL上述溶液,用浓度为0.0100mol/L的酸性
]是一种重要的化工原料,在定量分析、冶金等方面有重要应用。称取mg摩尔盐配置成100mL溶液。用移液管移取20mL上述溶液,用浓度为0.0100mol/L的酸性 溶液滴定,测定所配摩尔盐的浓度,写出该反应的离子方程式,并描述反应达到终点的实验现象。
溶液滴定,测定所配摩尔盐的浓度,写出该反应的离子方程式,并描述反应达到终点的实验现象。
(3)离子方程式:_______ 。
(4)达到终点的实验现象:_______ 。
(5)滴定过程的实验数据如下(其中 溶液体积的初始读数均为0.00mL):
溶液体积的初始读数均为0.00mL):
计算配得摩尔盐溶液的物质的量浓度_______ 。
(6)下述操作对摩尔盐浓度测定的影响,结果偏大的有_______ 。
a.滴至终点时有1滴酸性 溶液悬在管口处未滴入
溶液悬在管口处未滴入
b.待测液移入锥形瓶后,加入10mL蒸馏水
c.装酸性 溶液的滴定管中尖嘴气泡没赶出便开始滴定,滴定结束后气泡消失
溶液的滴定管中尖嘴气泡没赶出便开始滴定,滴定结束后气泡消失
(1)用0.2000mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作步骤如下:
①用蒸馏水洗涤碱式滴定管,注入0.2000mol/L的标准NaOH溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记下读数;
④量取20.00mL待测液注入洁净的锥形瓶中,并加入1-2滴甲基橙溶液;
⑤用标准液滴定至终点,记下滴定管液面读数。
⑥重复以上滴定操作2~3次。
以上步骤有错误的是
(2)现有常温条件下甲、乙、丙三种溶液,甲为0.1mol/L的NaOH溶液,乙为0.1mol/L的HCl溶液,丙为0.1mol/L的
 溶液,某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,选用酚酞作指示剂,得到如图所示两条滴定曲线。
溶液,某同学用甲溶液分别滴定20.00mL乙溶液和20.00mL丙溶液,选用酚酞作指示剂,得到如图所示两条滴定曲线。
①甲溶液滴定丙溶液的曲线是
②a=
Ⅱ.摩尔盐[
 ]是一种重要的化工原料,在定量分析、冶金等方面有重要应用。称取mg摩尔盐配置成100mL溶液。用移液管移取20mL上述溶液,用浓度为0.0100mol/L的酸性
]是一种重要的化工原料,在定量分析、冶金等方面有重要应用。称取mg摩尔盐配置成100mL溶液。用移液管移取20mL上述溶液,用浓度为0.0100mol/L的酸性 溶液滴定,测定所配摩尔盐的浓度,写出该反应的离子方程式,并描述反应达到终点的实验现象。
溶液滴定,测定所配摩尔盐的浓度,写出该反应的离子方程式,并描述反应达到终点的实验现象。(3)离子方程式:
(4)达到终点的实验现象:
(5)滴定过程的实验数据如下(其中
 溶液体积的初始读数均为0.00mL):
溶液体积的初始读数均为0.00mL):| 编号 | 所用 溶液的体积 溶液的体积 |  溶液体积的最终读数 溶液体积的最终读数 |
| Ⅰ | 20.00mL | 20.02mL |
| Ⅱ | 20.00mL | 20.00mL |
| Ⅲ | 20.00mL | 19.98mL |
(6)下述操作对摩尔盐浓度测定的影响,结果偏大的有
a.滴至终点时有1滴酸性
 溶液悬在管口处未滴入
溶液悬在管口处未滴入b.待测液移入锥形瓶后,加入10mL蒸馏水
c.装酸性
 溶液的滴定管中尖嘴气泡没赶出便开始滴定,滴定结束后气泡消失
溶液的滴定管中尖嘴气泡没赶出便开始滴定,滴定结束后气泡消失
更新时间:2022-11-14 20:53:01
|
相似题推荐
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂.
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式___________ (中和热数值为57.3kJ/mol):
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是_______________ (填序号).
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
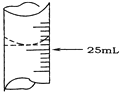
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为_________________ 。
(2)乙学生做了三组平行实验,数据记录如下:
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为________________ (小数点后保留四位)。
(3)下列哪些操作会使测定结果偏高___________ (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)滴定终点的判断__________________________
Ⅰ.测定中和热.
(1)写出稀盐酸和稀氢氧化钠溶液反应表示中和热的热化学方程式
(2)取50mL 0.5mol/L HCl溶液与50mL0.55mol/L NaOH溶液进行测定,但实验数值小于57.3kJ/mol,原因不可能是
A.用温度计测定NaOH溶液起始温度后直接测定盐酸的温度
B.量取盐酸的体积时仰视读数
C.分多次把NaOH溶液倒入盛有盐酸的小烧杯中
D.实验装置保温、隔热效果差
Ⅱ.酸碱中和滴定.
欲测定某NaOH溶液的物质的量浓度,可用0.1000 mol·L-1 HCl标准溶液进行中和滴定(用酚酞作指示剂)。请回答下列问题:
(1)若甲学生在实验过程中,记录滴定前滴定管内液面读数为1.10 mL,滴定后液面如图,则此时消耗标准溶液的体积为

(2)乙学生做了三组平行实验,数据记录如下:
| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.11 |
| 2 | 25.00 | 1.56 | 31.30 |
| 3 | 25.00 | 0.22 | 26.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为
(3)下列哪些操作会使测定结果偏高
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
(4)滴定终点的判断
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐2】按要求回答下列问题:
(1)一定温度下,现有:a.稀盐酸、b.稀硫酸、c.稀醋酸三种酸。
①相同体积、等pH的三种酸,使其恰好完全中和所需相同浓度NaOH溶液的体积由大到小的顺序是_______ (用a、b、c表示,下同)。
②体积相同、氢离子的物质的量浓度也相同的三种酸,向其中分别放入足量的锌(大小、形状相同),产生相同体积的H2(相同状况),则开始时反应速率由小到大的顺序为_______ 。
(2)现用中和滴定法测定某盐酸的浓度,某学生的操作步骤如下:
A.取NaOH标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
B.用标准溶液润洗滴定管2~3次
C.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
D.移取25.00mL待测盐酸溶液注入到洁净的锥形瓶中,并加入2~3滴酚酞溶液
E.调节液面至“0”或“0”以下刻度,记下读数
F.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液
有关数据记录如表:
①正确的操作顺序是_______ (填字母标号)。用碱式滴定管盛装0.2500mol/L的氢氧化钠标准液。排出碱式滴定管中气泡的方法应采用如图1操作中的_______ (填代号)。

②第一次滴定前后,50mL滴定管中液面的位置如图2,该次滴定所用氢氧化钠标准液的体积为_______ mL。

③实验中判断滴定终点的现象是_______ 。
④根据所给数据,该盐酸的物质的量浓度为_______ mol/L。
⑤出现了以下操作(其他操作正确),会造成测定结果(待测液浓度)偏高的有_______ (填标号)。
A.量取标准液的碱式滴定管未润洗 B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸润洗 D.滴定到达终点时,俯视滴定管读数
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
(1)一定温度下,现有:a.稀盐酸、b.稀硫酸、c.稀醋酸三种酸。
①相同体积、等pH的三种酸,使其恰好完全中和所需相同浓度NaOH溶液的体积由大到小的顺序是
②体积相同、氢离子的物质的量浓度也相同的三种酸,向其中分别放入足量的锌(大小、形状相同),产生相同体积的H2(相同状况),则开始时反应速率由小到大的顺序为
(2)现用中和滴定法测定某盐酸的浓度,某学生的操作步骤如下:
A.取NaOH标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
B.用标准溶液润洗滴定管2~3次
C.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
D.移取25.00mL待测盐酸溶液注入到洁净的锥形瓶中,并加入2~3滴酚酞溶液
E.调节液面至“0”或“0”以下刻度,记下读数
F.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液
有关数据记录如表:
| 滴定序号 | 待测液体积/ mL | NaOH标准液 | ||
| 滴定前的刻度/mL | 滴定后的刻度/ mL | 体积/ mL | ||
| 1 | 25.00 | |||
| 2 | 25.00 | 1.50 | 31.50 | 30.00 |
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |

②第一次滴定前后,50mL滴定管中液面的位置如图2,该次滴定所用氢氧化钠标准液的体积为

③实验中判断滴定终点的现象是
④根据所给数据,该盐酸的物质的量浓度为
⑤出现了以下操作(其他操作正确),会造成测定结果(待测液浓度)偏高的有
A.量取标准液的碱式滴定管未润洗 B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸润洗 D.滴定到达终点时,俯视滴定管读数
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】使用酸碱中和滴定法测定市售白醋的总酸量(g/100mL)。
Ⅰ.实验步骤:

(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到___________ (填仪器名称)中定容,摇匀即得。
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴_______ 作指示剂。
(3)读取盛装0.1000 mol/L NaOH 溶液的____________ (填仪器名称)的初始读数。如果液面位置如图所示,则此时的读数为__________ mL。
(4)滴定。当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=__________ g/100mL
(2)在本实验滴定过程中,下列操作会使结果偏大的是_________
a.碱式滴定管在滴定时未用标准氢氧化钠溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
Ⅰ.实验步骤:

(1)配制100mL待测白醋溶液。量取10.00mL食用白醋,注入烧杯中用水稀释后转移到
(2)取待测白醋溶液20.00 mL于锥形瓶中,向其中滴加2滴
(3)读取盛装0.1000 mol/L NaOH 溶液的
(4)滴定。当溶液由无色恰好变为红色,且半分钟内不褪色时,停止滴定,并记录NaOH溶液的终读数。重复滴定3次。
Ⅱ.实验记录
| 滴定次数 实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
Ⅲ.数据处理与讨论:
(1)经计算,市售白醋总酸量=
(2)在本实验滴定过程中,下列操作会使结果偏大的是
a.碱式滴定管在滴定时未用标准氢氧化钠溶液润洗
b.碱式滴定管的尖嘴在滴定前有气泡,滴定后气泡消失
c.锥形瓶中加入待测白醋溶液后,再加少量水
d.锥形瓶在滴定时剧烈摇动,有少量液体溅出
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐1】某化学兴趣小组的同学利用酸碱滴定法测定某变质烧碱样品(含Na2CO3杂质)中 NaOH 的质量分数。实验步骤如下:
(I)迅速地称取烧碱样品0.50 g,溶解后配制成100 mL溶液,备用。
(II)将0.1000 mol·L−1HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取 20.00mL 样品溶液于锥形瓶中,滴加 2 滴酚酞;以HCl 标准溶液滴定至第一终点,记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用 HCl 标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和__ 。酸式滴定管用蒸馏水洗净后、装入标准溶液并调零之前,应进行的操作是__ 。
(2)溶液中的H2CO3、 、
、 的物质的量分数随 pH 的变化如图所示:
的物质的量分数随 pH 的变化如图所示:
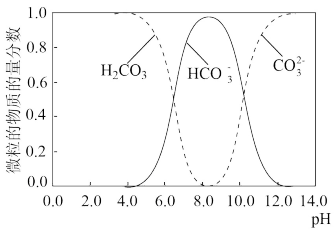
酚酞和甲基橙指示剂的变色pH范围及对应颜色见表。
①滴定至第一终点时,溶液中含碳微粒的主要存在形式为__ 。
②滴定至第一终点的过程中,发生反应的离子方程式为__ 。
③已知:pKa1= −lgKa1,结合图象可知,H2CO3的pKa1约为__ 。
a.5.0 b.6.4 c.8.0 d.10.3
(3)下列有关滴定的说法正确的是__ 。
a.滴定至第一终点时,溶液中 c(H+)+c(Na+) = 2c( ) + c(
) + c( ) + c(OH−)
) + c(OH−)
b.滴定至第一终点时,溶液中 n(Cl−) +n( ) + n(
) + n( ) + n(H2CO3) =n(Na+)
) + n(H2CO3) =n(Na+)
c.判断滴定至第二终点的现象是溶液由黄色变为橙色
d.记录酸式滴定管读数V1时,俯视标准液液面,会导致测得的NaOH质量分数偏低
(4)样品中NaOH的质量分数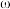 (NaOH) =
(NaOH) =__ %(计算结果保留小数点后 1 位)
(I)迅速地称取烧碱样品0.50 g,溶解后配制成100 mL溶液,备用。
(II)将0.1000 mol·L−1HCl标准溶液装入酸式滴定管,调零,记录起始读数V0;用碱式滴定管取 20.00mL 样品溶液于锥形瓶中,滴加 2 滴酚酞;以HCl 标准溶液滴定至第一终点,记录酸式滴定管的读数V1;然后再向锥形瓶内滴加2滴甲基橙,继续用 HCl 标准溶液滴定至第二终点,记录酸式滴定管的读数V2。重复上述操作两次,记录数据如下:
| 实验序号 | 1 | 2 | 3 |
| V0/ mL | 0.00 | 0.00 | 0.00 |
| V1/ mL | 22.22 | 22.18 | 22.20 |
| V2/ mL | 23.72 | 23.68 | 23.70 |
(1)步骤I中所需的玻璃仪器有烧杯、玻璃棒、胶头滴管和
(2)溶液中的H2CO3、
 、
、 的物质的量分数随 pH 的变化如图所示:
的物质的量分数随 pH 的变化如图所示: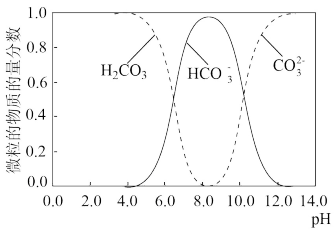
酚酞和甲基橙指示剂的变色pH范围及对应颜色见表。
| 酚酞 | 无色 pH < 8.0 | 粉红 pH 8.0~9.8 | 红 pH > 9.8 |
| 甲基橙 | 红 pH < 3.1 | 橙 pH 3.1~4.4 | 黄 pH > 4.4 |
①滴定至第一终点时,溶液中含碳微粒的主要存在形式为
②滴定至第一终点的过程中,发生反应的离子方程式为
③已知:pKa1= −lgKa1,结合图象可知,H2CO3的pKa1约为
a.5.0 b.6.4 c.8.0 d.10.3
(3)下列有关滴定的说法正确的是
a.滴定至第一终点时,溶液中 c(H+)+c(Na+) = 2c(
 ) + c(
) + c( ) + c(OH−)
) + c(OH−)b.滴定至第一终点时,溶液中 n(Cl−) +n(
 ) + n(
) + n( ) + n(H2CO3) =n(Na+)
) + n(H2CO3) =n(Na+)c.判断滴定至第二终点的现象是溶液由黄色变为橙色
d.记录酸式滴定管读数V1时,俯视标准液液面,会导致测得的NaOH质量分数偏低
(4)样品中NaOH的质量分数
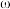 (NaOH) =
(NaOH) =
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐2】为测定某氟化稀土样品中氟元素的质量分数,某化学兴趣小组进行了如下实验。利用高氯酸(高沸点酸)将样品中的氟元素转化为氟化氢(低沸点酸)蒸出,再进行吸收滴定来测定含量。实验装置如图所示。
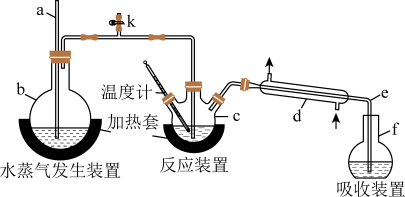
(1)装置c的名称是___________ 。玻璃管a的作用为___________ 。
(2)实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和 一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。
①下列物质可代替高氯酸的是___________ 。(填序号)。
A.硫酸B.盐酸C.硝酸D.磷酸
②水蒸气发生装置b的作用是___________ 。
(3)定量测定:将f中得到的馏出液配成100mL溶液,取其中20mL加入V1mL amol·L-1La(NO3)3溶液,得到LaF3沉淀(不考虑其他沉淀的生成),再用cmol·L-1EDTA 标准溶液滴定剩余La3+(La+与 EDTA 按1:1配合),消耗 EDTA 标准溶液 V2mL,则氟化稀土样品中氟的质量分数为___________ 。
(4)问题讨论:
若观察到f中溶液红色褪去,可采用最简单的补救措施是:___________ 。否则会使实验结果偏低。实验中除有HF 气体外,可能还有少量 SiF4(易水解)气体生成。若有SiF4生成,实验结果将_____ 。(填“偏高”“偏低”或“不受影响”)。理由是_____ 。

(1)装置c的名称是
(2)实验步骤:①连接好实验装置,检查装置气密性;②往c中加入mg氟化稀土样品和 一定体积的高氯酸,f中盛有滴加酚酞的NaOH溶液。加热装置b、c。
①下列物质可代替高氯酸的是
A.硫酸B.盐酸C.硝酸D.磷酸
②水蒸气发生装置b的作用是
(3)定量测定:将f中得到的馏出液配成100mL溶液,取其中20mL加入V1mL amol·L-1La(NO3)3溶液,得到LaF3沉淀(不考虑其他沉淀的生成),再用cmol·L-1EDTA 标准溶液滴定剩余La3+(La+与 EDTA 按1:1配合),消耗 EDTA 标准溶液 V2mL,则氟化稀土样品中氟的质量分数为
(4)问题讨论:
若观察到f中溶液红色褪去,可采用最简单的补救措施是:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
【推荐3】按要求回答下列问题:
(1)一定温度下,现有:a.稀盐酸、b.稀硫酸、c.稀醋酸三种酸。
①相同体积、等pH的三种酸,使其恰好完全中和所需相同浓度NaOH溶液的体积由大到小的顺序是_______ (用a、b、c表示,下同)。
②体积相同、氢离子的物质的量浓度也相同的三种酸,向其中分别放入足量的锌(大小、形状相同),产生相同体积的H2(相同状况),则开始时反应速率由小到大的顺序为_______ 。
(2)现用中和滴定法测定某盐酸的浓度,某学生的操作步骤如下:
A.取NaOH标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
B.用标准溶液润洗滴定管2~3次
C.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
D.移取25.00mL待测盐酸溶液注入到洁净的锥形瓶中,并加入2~3滴酚酞溶液
E.调节液面至“0”或“0”以下刻度,记下读数
F.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液
有关数据记录如表:
①正确的操作顺序是_______ (填字母标号)。用碱式滴定管盛装0.2500mol/L的氢氧化钠标准液。排出碱式滴定管中气泡的方法应采用如图1操作中的_______ (填代号)。

②第一次滴定前后,50mL滴定管中液面的位置如图2,该次滴定所用氢氧化钠标准液的体积为_______ mL。

③实验中判断滴定终点的现象是_______ 。
④根据所给数据,该盐酸的物质的量浓度为_______ mol/L。
⑤出现了以下操作(其他操作正确),会造成测定结果(待测液浓度)偏高的有_______ (填标号)。
A.量取标准液的碱式滴定管未润洗 B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸润洗 D.滴定到达终点时,俯视滴定管读数
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
(1)一定温度下,现有:a.稀盐酸、b.稀硫酸、c.稀醋酸三种酸。
①相同体积、等pH的三种酸,使其恰好完全中和所需相同浓度NaOH溶液的体积由大到小的顺序是
②体积相同、氢离子的物质的量浓度也相同的三种酸,向其中分别放入足量的锌(大小、形状相同),产生相同体积的H2(相同状况),则开始时反应速率由小到大的顺序为
(2)现用中和滴定法测定某盐酸的浓度,某学生的操作步骤如下:
A.取NaOH标准溶液注入碱式滴定管中至“0”刻度以上2~3mL
B.用标准溶液润洗滴定管2~3次
C.把锥形瓶放在滴定管的下面,用标准NaOH溶液滴定至终点并记下滴定管液面的刻度。
D.移取25.00mL待测盐酸溶液注入到洁净的锥形瓶中,并加入2~3滴酚酞溶液
E.调节液面至“0”或“0”以下刻度,记下读数
F.把盛有标准溶液的碱式滴定管固定好,调节滴定管使尖嘴部分充满溶液
有关数据记录如表:
| 滴定序号 | 待测液体积/ mL | NaOH标准液 | ||
| 滴定前的刻度/mL | 滴定后的刻度/ mL | 体积/ mL | ||
| 1 | 25.00 | |||
| 2 | 25.00 | 1.50 | 31.50 | 30.00 |
| 3 | 25.00 | 5.00 | 31.34 | 26.34 |

②第一次滴定前后,50mL滴定管中液面的位置如图2,该次滴定所用氢氧化钠标准液的体积为

③实验中判断滴定终点的现象是
④根据所给数据,该盐酸的物质的量浓度为
⑤出现了以下操作(其他操作正确),会造成测定结果(待测液浓度)偏高的有
A.量取标准液的碱式滴定管未润洗 B.锥形瓶水洗后直接装待测液
C.酸式滴定管水洗后未用待测稀盐酸润洗 D.滴定到达终点时,俯视滴定管读数
E.滴定前碱式滴定管尖嘴部分有气泡,滴定后气泡消失
您最近一年使用:0次



