填空。
(1)由几种离子组成的混合物中可能含有下列离子中的若干种: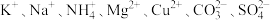 。将该混合物溶于水后得到澄清的溶液,现取三份各
。将该混合物溶于水后得到澄清的溶液,现取三份各 该溶液分别进行如下实验:
该溶液分别进行如下实验:
请回答下列问题:
①实验1说明存在的离子是_______ (填离子符号,下同),一定不存在的离子是_______ 。
②溶液中 的范围是
的范围是_______ 。
(2)电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。在两份相同的 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的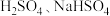 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
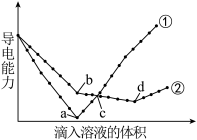
下列分析正确的是_______。
(3)甲同学认为(1)实验3能证明溶液中存在 ,乙同学认为不能证明。那么甲同学如何利用题目涉及药品证明溶液中一定存在
,乙同学认为不能证明。那么甲同学如何利用题目涉及药品证明溶液中一定存在 :
:_______ 。
(1)由几种离子组成的混合物中可能含有下列离子中的若干种:
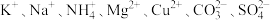 。将该混合物溶于水后得到澄清的溶液,现取三份各
。将该混合物溶于水后得到澄清的溶液,现取三份各 该溶液分别进行如下实验:
该溶液分别进行如下实验:| 实验序号 | 实验内容 | 实验结果 |
| 1 | 加入盐酸 | 有气泡产生 |
| 2 | 加入足量浓 溶液并加热 溶液并加热 | 收集到标准状况下的气体 |
| 3 | 加入足量 溶液,对所得沉淀进行洗涤、干燥、称量; 溶液,对所得沉淀进行洗涤、干燥、称量; | 第一次称量读数为 ;再向沉淀中加入足量盐酸,然后过滤、洗涤、干燥、称量,第二次称量读数为 ;再向沉淀中加入足量盐酸,然后过滤、洗涤、干燥、称量,第二次称量读数为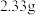 |
①实验1说明存在的离子是
②溶液中
 的范围是
的范围是(2)电解质溶于水时会发生电离产生自由移动的离子,电导率变化一定程度上可以反映溶液中自由移动的离子浓度变化。在两份相同的
 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的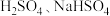 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
下列分析正确的是_______。
A.①代表滴加 溶液的变化曲线 溶液的变化曲线 |
B.b点,溶液中大量存在的离子是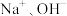 |
| C.a、d两点对应的溶液均显中性 |
D. 导电能力比 导电能力比 弱 弱 |
 ,乙同学认为不能证明。那么甲同学如何利用题目涉及药品证明溶液中一定存在
,乙同学认为不能证明。那么甲同学如何利用题目涉及药品证明溶液中一定存在 :
:
更新时间:2022-11-21 10:31:28
|
相似题推荐
解答题-无机推断题
|
较难
(0.4)
名校
解题方法
【推荐1】I.某无色透明溶液可能含有Cu2+、Ca2+、K+、Ag+、SO 、CO
、CO 、C1-中的几种,现进行如下实验:
、C1-中的几种,现进行如下实验:
①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀硝酸,沉淀部分溶解。
③向①滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
(1)试判断:该溶液中肯定有___________ ,肯定没有___________ ,可能有___________ (填离子符号)。
(2)写出步骤②发生反应的离子方程式___________ 。
(3)若要检验溶液中可能存在的离子是否存在,可以进行的实验操作为___________ 。
Ⅱ.完成下列问题
(4)某溶液中含有较大量的Cl-、CO 、OH-,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
、OH-,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是___________ 。(填写序号,可重复使用)
①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
Ⅲ.下面三个方法都可以用来制氯气:
①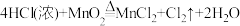
②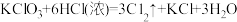
③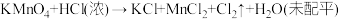
根据以上三个反应,回答下列有关问题:
(5)反应②中,氧化产物与还原产物的质量比为___________ 。
(6)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为___________ 。
 、CO
、CO 、C1-中的几种,现进行如下实验:
、C1-中的几种,现进行如下实验:①滴加BaCl2溶液,有白色沉淀产生,将沉淀滤出。
②向上述沉淀中加入足量的稀硝酸,沉淀部分溶解。
③向①滤液加入AgNO3溶液,有白色沉淀生成,该沉淀不溶于稀HNO3。
(1)试判断:该溶液中肯定有
(2)写出步骤②发生反应的离子方程式
(3)若要检验溶液中可能存在的离子是否存在,可以进行的实验操作为
Ⅱ.完成下列问题
(4)某溶液中含有较大量的Cl-、CO
 、OH-,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是
、OH-,如果只取一次该溶液就能够分别将3种阴离子依次检验出来,下列实验操作顺序正确的是①滴加Mg(NO3)2溶液;②过滤;③滴加AgNO3溶液;④滴加Ba(NO3)2溶液
Ⅲ.下面三个方法都可以用来制氯气:
①
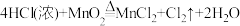
②
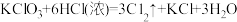
③
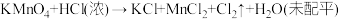
根据以上三个反应,回答下列有关问题:
(5)反应②中,氧化产物与还原产物的质量比为
(6)若要制得相同质量的氯气,①②③反应中电子转移的数目之比为
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】按要求回答问题
(1)Ca(OH)2溶液与少量NaHCO3溶液反应的离子方程式:___________ 。
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH 、Cl-、SO
、Cl-、SO 、 NO
、 NO 、CO
、CO 中的若干种离子。某同学取50 mL的溶液进行如下实验:
中的若干种离子。某同学取50 mL的溶液进行如下实验:

根据实验判断下列说法中正确的是___________
A.原溶液中一定只含有NH 、Mg2+、SO
、Mg2+、SO 、Cl-
、Cl-
B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、CO 、NO
、NO
C.原溶液中可能含有NO
D.原溶液中c(K+)=2mol/L
(3)已知:①H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
②O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
④H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
请写出液氢和液氧生成气态水的热化学方程式:___________
(4)已知 4NO2+2CO(NH2)2=2CO2+4N2+4H2O+O2(已知尿素中N为-3 价),该反应的氧化产物为___________ ;若吸收0.15 mol NO2,则转移电子___________ mol。
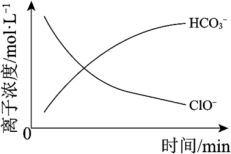
(5)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、HCO 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式___________ 。
(1)Ca(OH)2溶液与少量NaHCO3溶液反应的离子方程式:
(2)某无色透明溶液中可能含有K+、Fe2+、Fe3+、Mg2+、Ba2+、NH
 、Cl-、SO
、Cl-、SO 、 NO
、 NO 、CO
、CO 中的若干种离子。某同学取50 mL的溶液进行如下实验:
中的若干种离子。某同学取50 mL的溶液进行如下实验:
根据实验判断下列说法中正确的是
A.原溶液中一定只含有NH
 、Mg2+、SO
、Mg2+、SO 、Cl-
、Cl-B.原溶液中一定不存在 Fe2+、Fe3+、Ba2+、CO
 、NO
、NO
C.原溶液中可能含有NO

D.原溶液中c(K+)=2mol/L
(3)已知:①H2(g)=H2(l) ΔH=-0.92 kJ·mol-1
②O2(g)=O2(l) ΔH=-6.84 kJ·mol-1
③H2O(l)=H2O(g) ΔH=+44.0 kJ·mol-1
④H2(g)+
 O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1请写出液氢和液氧生成气态水的热化学方程式:
(4)已知 4NO2+2CO(NH2)2=2CO2+4N2+4H2O+O2(已知尿素中N为-3 价),该反应的氧化产物为
(5)处理某废水时,反应过程中部分离子浓度与反应进程关系如图,反应过程中主要存在N2、HCO
 、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
、ClO−、CNO−(C+4 价)、Cl−等微粒。写出处理该废水时发生反应的离子方程式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度均为0.1 molL-1 。
某同学欲探究该废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有_____________ ,阴离子有__________ 。(写离子符号)
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为___________________________ 。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液中溶质的物质的量浓度为___________ molL-1 (精确到小数点后第三位)。
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为______ g。
| 阳离子 | K+、Cu2+、Fe3+、Al3+、Fe2+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得溶液中加入BaCl2溶液,有白色沉淀生成。
请回答下列问题:
(1)甲同学最终确定原溶液中所含阳离子有
(2)Ⅲ中加入少量盐酸生成无色气体的离子方程式为
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液中溶质的物质的量浓度为
(4)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体的质量为
您最近一年使用:0次
解答题-无机推断题
|
较难
(0.4)
【推荐1】根据要求,回答下列问题:
I.某溶液由Na+、Al3+、Fe3+、NH 、Cl-、NO
、Cl-、NO 、CO
、CO 、SO
、SO 中的若干种离子所组成,且各离子的物质的量浓度相同。为确定其组成,现取适量溶液进行如下实验。
中的若干种离子所组成,且各离子的物质的量浓度相同。为确定其组成,现取适量溶液进行如下实验。
步骤i:加入过量NaOH溶液,加热,产生气体和沉淀;
步骤ii:过滤,得滤液、滤渣;
步骤iii:取滤渣,洗涤、灼烧,得固体W;
步骤iv:取少量滤液,加入足量BaCl2溶液,产生白色沉淀。
(1)步骤iii所得固体W为________ (填化学式)。
(2)原溶液中一定存在的离子是_______ ,原溶液中一定不存在的离子是_______ 。
Ⅱ.Cr、Ca、O可形成一种具有特殊导电性的晶体(化学式为CaxCrOy,x、y为整数),其立方晶胞如图所示,Ca与O最小间距大于Cr与O最小间距。
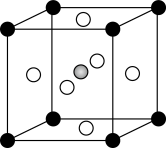
(3)Cr在晶胞中的位置为________ (填“顶点”“面心”或“体心”)。晶体中1个Ca周围与其最近的O的个数为_______ 。若Ca与O最小间距为apm,阿伏加德罗常数为NA,则该晶体的密度为________ g•cm-3(列出计算式)。
I.某溶液由Na+、Al3+、Fe3+、NH
 、Cl-、NO
、Cl-、NO 、CO
、CO 、SO
、SO 中的若干种离子所组成,且各离子的物质的量浓度相同。为确定其组成,现取适量溶液进行如下实验。
中的若干种离子所组成,且各离子的物质的量浓度相同。为确定其组成,现取适量溶液进行如下实验。步骤i:加入过量NaOH溶液,加热,产生气体和沉淀;
步骤ii:过滤,得滤液、滤渣;
步骤iii:取滤渣,洗涤、灼烧,得固体W;
步骤iv:取少量滤液,加入足量BaCl2溶液,产生白色沉淀。
(1)步骤iii所得固体W为
(2)原溶液中一定存在的离子是
Ⅱ.Cr、Ca、O可形成一种具有特殊导电性的晶体(化学式为CaxCrOy,x、y为整数),其立方晶胞如图所示,Ca与O最小间距大于Cr与O最小间距。

(3)Cr在晶胞中的位置为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐2】明矾石的主要成分是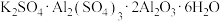 ,还含有少量
,还含有少量 杂质。利用明矾石制备
杂质。利用明矾石制备 和
和 晶体的流程如图:
晶体的流程如图:
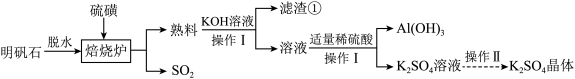
已知:焙烧炉中发生反应的化学方程式为 ,回答下列问题:
,回答下列问题:
(1)“滤渣①”的主要成分为_______ ,“操作Ⅰ”的名称为_______ ,实验室进行“操作Ⅱ”时,需要使用下列仪器中的_______ 。
a.坩埚 b.蒸发皿 c.铁架台(带铁圈) d.玻璃棒 e.烧杯
(2)“熟料”与 溶液反应的离子方程式为
溶液反应的离子方程式为_______ 。
(3)生成的 需进一步洗涤干燥,证明
需进一步洗涤干燥,证明 沉淀已洗涤干净的实验操作和现象是
沉淀已洗涤干净的实验操作和现象是_______ 。
(4)若“焙烧”过程中恰好消耗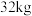 硫黄,则理论上最终可得到
硫黄,则理论上最终可得到_______  氢氧化铝。
氢氧化铝。
 ,还含有少量
,还含有少量 杂质。利用明矾石制备
杂质。利用明矾石制备 和
和 晶体的流程如图:
晶体的流程如图:
已知:焙烧炉中发生反应的化学方程式为
 ,回答下列问题:
,回答下列问题:(1)“滤渣①”的主要成分为
a.坩埚 b.蒸发皿 c.铁架台(带铁圈) d.玻璃棒 e.烧杯
(2)“熟料”与
 溶液反应的离子方程式为
溶液反应的离子方程式为(3)生成的
 需进一步洗涤干燥,证明
需进一步洗涤干燥,证明 沉淀已洗涤干净的实验操作和现象是
沉淀已洗涤干净的实验操作和现象是(4)若“焙烧”过程中恰好消耗
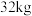 硫黄,则理论上最终可得到
硫黄,则理论上最终可得到 氢氧化铝。
氢氧化铝。
您最近一年使用:0次



