按要求完成下列填空,
(1)配制240mL4.0mol•L-1NaOH溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量;
b.用滤纸称量氢氧化钠固体
c.用适量的蒸馏水溶解称量好的氢氧化钠固体,直接注入容量瓶;
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶使溶液混合均匀;
e.继续向容量瓶中加蒸馏水至刻度线下1mm~2mm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
f.盖好瓶塞,反复左右颠倒,摇匀;
g.装瓶贴签。
①所需称量的氢氧化钠固体的质量是_____ 。
②配制上述溶液的操作正确的是_____ (填序号)。
③在配制过程中,其他操作均正确,下列操作能引起所得溶液浓度偏高的是_____ (填序号)。
A.定容时,俯视刻度线
B.定容摇匀后,发现液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度线
C.转移前,发现容量瓶内含有少量蒸馏水
D.称量时使用的砝码生锈
(2)已知该水样中只可能含有K+、Mg2+、Cu2+、Ag+、Ca2+、 、
、 、Cl-中的若干种离子,该小组同学取100mL水样进行实验;向样品中先滴加氯化钡溶液,再滴加1mol•L-1盐酸,实验过程中沉淀质量的变化如图所示。
、Cl-中的若干种离子,该小组同学取100mL水样进行实验;向样品中先滴加氯化钡溶液,再滴加1mol•L-1盐酸,实验过程中沉淀质量的变化如图所示。
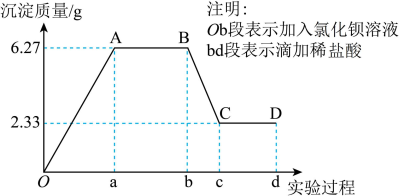
BC段消耗盐酸体积为_____ ,若检测得到c(K+)=0.7mol•L-1,则水样中存在的离子为_____ 。
(3)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。
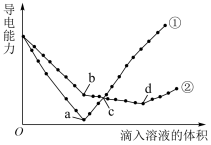
下列分析正确的是_____ 。
(4)将0.24gMg和0.27gAl的混合物投入到100mL1mol/L的盐酸中,充分反应后固体完全溶解。向所得溶液中加入2mol/L的NaOH溶液,恰好使金属离子全部沉淀完全,需要NaOH溶液的体积为_____ mL。
(1)配制240mL4.0mol•L-1NaOH溶液的实验步骤如下:
a.计算需要氢氧化钠固体的质量;
b.用滤纸称量氢氧化钠固体
c.用适量的蒸馏水溶解称量好的氢氧化钠固体,直接注入容量瓶;
d.用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液也注入容量瓶,轻轻摇动容量瓶使溶液混合均匀;
e.继续向容量瓶中加蒸馏水至刻度线下1mm~2mm时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切;
f.盖好瓶塞,反复左右颠倒,摇匀;
g.装瓶贴签。
①所需称量的氢氧化钠固体的质量是
②配制上述溶液的操作正确的是
③在配制过程中,其他操作均正确,下列操作能引起所得溶液浓度偏高的是
A.定容时,俯视刻度线
B.定容摇匀后,发现液面低于刻度线,又用胶头滴管滴加蒸馏水至刻度线
C.转移前,发现容量瓶内含有少量蒸馏水
D.称量时使用的砝码生锈
(2)已知该水样中只可能含有K+、Mg2+、Cu2+、Ag+、Ca2+、
 、
、 、Cl-中的若干种离子,该小组同学取100mL水样进行实验;向样品中先滴加氯化钡溶液,再滴加1mol•L-1盐酸,实验过程中沉淀质量的变化如图所示。
、Cl-中的若干种离子,该小组同学取100mL水样进行实验;向样品中先滴加氯化钡溶液,再滴加1mol•L-1盐酸,实验过程中沉淀质量的变化如图所示。
BC段消耗盐酸体积为
(3)在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。

下列分析正确的是
| A.①代表滴加H2SO4溶液的变化曲线 | B.b-d的反应为H++OH-=H2O |
| C.a、d两点对应的溶液均显中性 | D.H+导电能力比Na+弱 |
更新时间:2022-12-09 12:42:29
|
相似题推荐
解答题-原理综合题
|
适中
(0.65)
【推荐1】氮、磷元素形成的单质和化合物在生产、生活中具有广泛的应用,对它们的研究具有重要的价值和意义。
已知:Ⅰ. N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ⋅mol−1
Ⅱ. 2NO(g)+O2(g)=2NO2(g) ΔH=−167.7kJ⋅mol−1
Ⅲ. 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=−809.6kJ⋅mol−1
回答下列问题:
(1)在热力学上反应Ⅱ比反应I趋势更大,原因是_______ 。
(2)研究发现反应Ⅱ分两步进行:
第一步:2NO(g)=N2O2(g) ΔH<0快反应;
第二步:N2O2(g)+O2(g)=2NO2(g) ΔH<0慢反应;
下列有关叙述正确的是_______ 。
A.反应速率:v(第一步)>v(第二步)
B.活化能:E(第一步)>E(第二步)
C.决定反应Ⅱ速率快慢的步骤为第二步
D.第二步的v正=k正c(N2O2)∙c(O2)、v逆=k逆c2(NO2),则第二步的平衡常数K=k正∙k逆
(3)将NH3与O2按体积比4:5充入体积不变的容器中,起始体系总压强为45kPa,分别在催化剂M、N作用下发生反应Ⅲ,NO的分压(p)与反应时间(t)和温度(T)的关系如图:

由图像可判断反应温度:T1_______ T2(填“>”“<”或“=”,下同),催化剂效率:催化剂M_______ 催化剂N,T1℃时,在催化剂M作用下,0~10min内的平均反应速率v[NH3(g)]=_______ kPa∙min-1。
(4)已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2。H3PO2水溶液中存在H3PO2分子。
①NaH2PO2是_______ (填“正盐”、“酸式盐”或“碱式盐”)。
②向H3PO2溶液中逐滴加入等浓度的NaOH溶液至过量,其导电性变化图像为_______ ;向稀NaOH溶液中逐滴滴加浓H3PO2溶液至恰好中和,其导电性变化图像为_______ 。
A.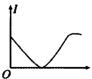 B.
B.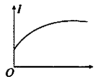 C.
C. D.
D.
已知:Ⅰ. N2(g)+O2(g)=2NO(g) ΔH=+180.5kJ⋅mol−1
Ⅱ. 2NO(g)+O2(g)=2NO2(g) ΔH=−167.7kJ⋅mol−1
Ⅲ. 4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH=−809.6kJ⋅mol−1
回答下列问题:
(1)在热力学上反应Ⅱ比反应I趋势更大,原因是
(2)研究发现反应Ⅱ分两步进行:
第一步:2NO(g)=N2O2(g) ΔH<0快反应;
第二步:N2O2(g)+O2(g)=2NO2(g) ΔH<0慢反应;
下列有关叙述正确的是
A.反应速率:v(第一步)>v(第二步)
B.活化能:E(第一步)>E(第二步)
C.决定反应Ⅱ速率快慢的步骤为第二步
D.第二步的v正=k正c(N2O2)∙c(O2)、v逆=k逆c2(NO2),则第二步的平衡常数K=k正∙k逆
(3)将NH3与O2按体积比4:5充入体积不变的容器中,起始体系总压强为45kPa,分别在催化剂M、N作用下发生反应Ⅲ,NO的分压(p)与反应时间(t)和温度(T)的关系如图:

由图像可判断反应温度:T1
(4)已知H3PO2(次磷酸)与足量的NaOH反应只生成一种盐NaH2PO2。H3PO2水溶液中存在H3PO2分子。
①NaH2PO2是
②向H3PO2溶液中逐滴加入等浓度的NaOH溶液至过量,其导电性变化图像为
A.
 B.
B. C.
C. D.
D.
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐2】现有以下物质:①NaOH溶液;②液氨;③明矾;④熔融KHSO4;⑤Fe(OH)3胶体;⑥铜;⑦CO2;⑧CH3COOH;⑨蔗糖;⑩冰水混合物
(1)以上物质中属于混合物的是__________ (填序号),以上物质中属于电解质的是_______ (填序号);以上纯净物中能导电的是_________________ (填序号)。
(2)写出制备物质⑤的化学方程式___________________ ,在小烧杯中加入20 mL蒸馏水,加热至沸腾后,向沸水中滴入几滴饱和FeCl3溶液,继续煮沸至溶液呈______ 色,即制得Fe(OH)3胶体。如何用最简单的方法判断是否成功制备出胶体________________ ?
(3)写出③溶于水的电离方程式________________ 。
(4)写出④的电离方程式________________ 。
(1)以上物质中属于混合物的是
(2)写出制备物质⑤的化学方程式
(3)写出③溶于水的电离方程式
(4)写出④的电离方程式
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐3】某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1mol⋅L (忽略水的电离)。
(忽略水的电离)。
甲同学欲探究废水的组成,进行了如下实验:
I.取该无色溶液5mL,滴加一滴氨水(主要成分为 )有沉淀生成,且离子种类增加。
)有沉淀生成,且离子种类增加。
Ⅱ.另取溶液加入过量盐酸,无气体生成。
Ⅲ.向Ⅱ中所得的溶液中加入 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。
请回答下列问题:
(1)以下物质属于电解质的是___________ ,能导电的是___________ 。(都填字母)。
A.氨气 B.氨水 C.液氨 D.一水合氨
(2)经测定原溶液中有 ,根据上述信息推断一定存在的离子还有
,根据上述信息推断一定存在的离子还有___________ 种。
(3)实验I中发生反应的离子方程式为___________ 。
(4)实验Ⅲ中发生反应的离子方程式有___________ 、___________ 。
(5)向原溶液加入等体积0.1mol⋅L-1的 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为___________ ,反应后所得溶液溶质的化学式为___________ 。
 (忽略水的电离)。
(忽略水的电离)。| 阳离子 |  |  |  |  |  |
| 阴离子 |  |  |  |  |  |
I.取该无色溶液5mL,滴加一滴氨水(主要成分为
 )有沉淀生成,且离子种类增加。
)有沉淀生成,且离子种类增加。Ⅱ.另取溶液加入过量盐酸,无气体生成。
Ⅲ.向Ⅱ中所得的溶液中加入
 溶液,有白色沉淀生成。
溶液,有白色沉淀生成。请回答下列问题:
(1)以下物质属于电解质的是
A.氨气 B.氨水 C.液氨 D.一水合氨
(2)经测定原溶液中有
 ,根据上述信息推断一定存在的离子还有
,根据上述信息推断一定存在的离子还有(3)实验I中发生反应的离子方程式为
(4)实验Ⅲ中发生反应的离子方程式有
(5)向原溶液加入等体积0.1mol⋅L-1的
 溶液,发生反应的离子方程式为
溶液,发生反应的离子方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】如图为配制480 mL 0.2 mol·L-1 NaCl溶液的示意图。
(1)在容量瓶的使用方法中,下列操作不正确的是________ (填字母)。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
D.溶解过程中,要等烧杯中溶液冷却到室温再转入容量瓶
(2)①中应称NaCl________ g;②选择容量瓶的规格____________ 。
(3)玻璃棒在②、③两步中的作用分别是____________________________ 、____________________________ 。
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第①步称量时物品和砝码放反了________ 。
B.某同学在第⑧步观察液面时仰视________ ;

回答下列问题:
(1)在容量瓶的使用方法中,下列操作不正确的是
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配溶液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线1~2 cm处,用胶头滴管滴加蒸馏水到刻度线
D.溶解过程中,要等烧杯中溶液冷却到室温再转入容量瓶
(2)①中应称NaCl
(3)玻璃棒在②、③两步中的作用分别是
(4)若出现如下情况,对所配溶液浓度有何影响?(填“偏高”“偏低”或“无影响”)
A.某同学在第①步称量时物品和砝码放反了
B.某同学在第⑧步观察液面时仰视
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某同学进行实验时需要240 mL0.20 mol/LNa2CO3溶液,但实验室只有碳酸钠晶体(Na2CO3∙10H2O)和2.00 mol/L Na2CO3溶液。该同学利用所给试剂配制所需溶液。
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种玻璃仪器是___________ 。
(2)若用碳酸钠晶体(Na2CO3∙10H2O)配制250 mL所需溶液,需要用电子天平称取晶体的质量为___________ g;若用2.00 mol/L Na2CO3溶液配制250 mL所需溶液,需要用量筒量取___________ mL溶液。
(3)根据下列配制溶液的过程示意图,请写出过程③的名称___________ 。

(4)定容操作:将蒸馏水注入容量瓶,当液面离容量瓶颈部刻度线___________ 时,改用___________ 滴加蒸馏水至溶液的凹液面与刻度线相切。盖好瓶塞,反复上下颠倒,摇匀。
(5)下列有关说法正确的是___________ 。
a.容量瓶使用前需检查是否漏水
b.容量瓶可加热,但加热时需垫石棉网
c.定容时,俯视刻度线,所得溶液浓度偏低
d.用碳酸钠晶体(Na2CO3∙10H2O)来配制溶液,若晶体久置已部分失去结晶水,所得溶液浓度偏高
e.在配制溶液时,不能在容量瓶中直接溶解溶质固体,但可在容量瓶中稀释浓溶液
(1)无论采用何种试剂进行配制,实验必须用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,至少还需要的一种玻璃仪器是
(2)若用碳酸钠晶体(Na2CO3∙10H2O)配制250 mL所需溶液,需要用电子天平称取晶体的质量为
(3)根据下列配制溶液的过程示意图,请写出过程③的名称

(4)定容操作:将蒸馏水注入容量瓶,当液面离容量瓶颈部刻度线
(5)下列有关说法正确的是
a.容量瓶使用前需检查是否漏水
b.容量瓶可加热,但加热时需垫石棉网
c.定容时,俯视刻度线,所得溶液浓度偏低
d.用碳酸钠晶体(Na2CO3∙10H2O)来配制溶液,若晶体久置已部分失去结晶水,所得溶液浓度偏高
e.在配制溶液时,不能在容量瓶中直接溶解溶质固体,但可在容量瓶中稀释浓溶液
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】欲用98%的浓硫酸(p=1.84g·cm-3 )配制成浓度为0.5mol·L-1的稀硫酸500ml。
(1)配制时必需的玻璃仪器有:________________ ;
(2)在配置过程中,下列操作不正确的是(填序号)__________ 。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解.
D.将准确量取的浓硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(3)简要回答下列问题:
①所需浓硫酸的体积为____________ mL。
②如果实验室有15mL、20mL、50mL的量筒应选用____________ mL的量筒最好.
(4)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会________ (填“偏高”、“偏低”或“无影响”下同),②未经冷却趁热将溶液注入容量瓶中,_______ ,③容量瓶中原有少量蒸馏水,________ 。
(1)配制时必需的玻璃仪器有:
(2)在配置过程中,下列操作不正确的是(填序号)
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解.
D.将准确量取的浓硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(3)简要回答下列问题:
①所需浓硫酸的体积为
②如果实验室有15mL、20mL、50mL的量筒应选用
(4)在配制过程中,①某学生观察定容时仰视液面,所配溶液的浓度会
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐1】I、某学生用已知物质的量浓度的硫酸来测定未知物质的量浓度的NaOH溶液时,选择酚酞作指示剂。回答下列问题:
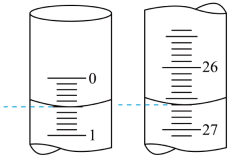
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是_______ 。
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为_______ mL。
(3)某学生根据3次实验分别记录有关数据如下表:
依据上表数据计算可得该NaOH溶液的物质的量浓度为_______ mol/L(保留四位有效数字)。
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______ (填字母)。
II、某实验小组用氢氧化钠溶液和0.50mol/L硫酸溶液进行中和热的测定
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则计算得中和热△H=_______ (取小数点后一位)。
(6)上述实验结果与-57.3kJ/mol有偏差,产生偏差的原因可能是_______ (填字母)。
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
(1)用标准的硫酸滴定待测的NaOH溶液时,终点现象是
(2)若滴定开始和结束时,酸式滴定管中的液面如图所示,则所用硫酸溶液的体积为

(3)某学生根据3次实验分别记录有关数据如下表:
| 测定次数 | 待测NaOH溶液的体积/mL | 0.1000mol/L硫酸的体积/L | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(4)下列操作中可能使所测NaOH溶液的浓度数值偏低的是_______ (填字母)。
| A.酸式滴定管未用标准硫酸润洗就直接注入标准硫酸 |
| B.读取硫酸体积时,开始仰视读数,滴定结束时俯视读数 |
| C.酸式滴定管在滴定前有气泡,滴定后气泡消失 |
| D.锥形瓶用水洗涤后,用待测液润洗 |
II、某实验小组用氢氧化钠溶液和0.50mol/L硫酸溶液进行中和热的测定
(5)取50mLNaOH溶液和30mL硫酸溶液进行实验,测得起止温度差的平均值为4.0℃。近似认为0.50mol/LNaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g·℃)。则计算得中和热△H=
(6)上述实验结果与-57.3kJ/mol有偏差,产生偏差的原因可能是
a.实验装置保温、隔热效果差
b.用量筒量取NaOH溶液的体积时仰视刻度线读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】已知某“84消毒液”瓶体部分标签如图所示,现实验室欲用NaClO固体配制500mL该浓度的消毒液。请回答下列问题:
(1)该“84消毒液”的物质的量浓度约为___________ mol·L-1(保留一位小数);需NaClO固体___________ 克。
(2)配液过程中需要的定量仪器有___________ ;实验开始前,需要检查___________ 。
(3)下图是配制溶液的几个关键实验步骤和操作。
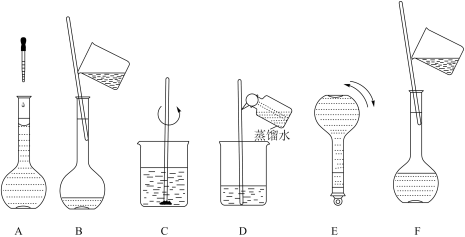
将上述实验步骤A-E按实验过程先后次序排列___________ 。步骤B通常称为转移,步骤A通常称为___________ ;步骤D称为___________ ,这步操作的目的是___________ 。
(4)若所配制的次氯酸钠溶液浓度偏小,原因可能是下列分析中的___________。
(5)“84消毒液”与稀硫酸混合使用可增强消毒能力,某小组用18.4mol/L的浓硫酸配制250mL2.4mol/L的稀硫酸用于增强“84消毒液”的消毒能力。需用___________ 量取浓硫酸的体积为___________ mL;因浓硫酸遇水放出大量的热,所以配液过程中应注意:___________ 。
| 84消毒液 (有效成分)NaClO (规格)1000mL (质量分数)25% (密度)1.19g/cm3 |
(2)配液过程中需要的定量仪器有
(3)下图是配制溶液的几个关键实验步骤和操作。

将上述实验步骤A-E按实验过程先后次序排列
(4)若所配制的次氯酸钠溶液浓度偏小,原因可能是下列分析中的___________。
| A.配制前,容量瓶中有少量蒸馏水 | B.洗涤液未转移到容量瓶中 |
| C.定容时水多、超过刻度线,用胶头滴管吸出 | D.定容时,俯视溶液的凹液面 |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐3】亚硫酸钠是重要的化工原料,常用作还原剂、防腐剂、去氯剂等。回答下列问题:
(1)要配制250mL0.5mol/L的Na2SO3溶液,需要用托盘天平称取Na2SO3·7H2O晶体________ g。配制溶液所用到的玻璃仪器有:玻璃棒、烧杯、量筒和_________________ 。
(2)配制过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是________ 。
(3)下列操作会使所配溶液浓度偏高的是________ 。
A.所选用的溶质已经失去部分结晶水 B.亚硫酸钠晶体与砝码位置放反了
C.转移溶液时玻璃棒靠在刻度线上方 D.定容时俯视容量瓶的刻度线
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切
(4)Na2SO3放在空气中容易被氧化变质。检验Na2SO3溶液是否变质的方法是_______ 。
(1)要配制250mL0.5mol/L的Na2SO3溶液,需要用托盘天平称取Na2SO3·7H2O晶体
(2)配制过程中所用蒸馏水需煮沸、冷却后才能使用,煮沸蒸馏水的目的是
(3)下列操作会使所配溶液浓度偏高的是
A.所选用的溶质已经失去部分结晶水 B.亚硫酸钠晶体与砝码位置放反了
C.转移溶液时玻璃棒靠在刻度线上方 D.定容时俯视容量瓶的刻度线
E.摇匀后溶液低于刻度线,再加入蒸馏水使液面最低点与刻度线相切
(4)Na2SO3放在空气中容易被氧化变质。检验Na2SO3溶液是否变质的方法是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】某实验小组利用含有硫酸铜的工业废水制备硫酸铵晶体,其反应流程如图所示,并利用电位滴定法测定硫酸铵中氮的含量。
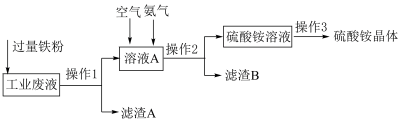
回答下列问题:硫酸铵晶体的制备。
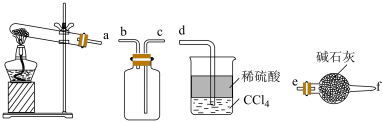
(1)实验室制备、收集较纯净 ,下图所示装置正确的连接顺序是
,下图所示装置正确的连接顺序是___________ (按气流从左到右的方向,用仪器接口小写字母表示);A装置中发生反应的化学方程式为___________ ;C装置中 的作用是
的作用是___________ 。
(2)加入过量铁粉的目的是___________ ;滤渣B的成分为___________ (填化学式),写出“空气、氨气通入到溶液A”发生反应的离子方程式:___________ 。
(3)操作3是指___________ 。
电位滴定法测定硫酸铵中氮的含量。
①硫酸铵分析试液的配制。
准确称量1.458g硫酸铵晶体,放入100mL小烧杯中,加蒸馏水溶解后定容于250mL容量瓶中待用。
②滴定终点电位的确定。
准确移取25.00mI硫酸铵分析试液并放于100mL小烧杯中,加5mL蒸馏水,加入磁子,插入电极,放于磁力搅拌器上,开动搅拌,用0.09759 NaOH标准溶液滴定硫酸铵分析试液,以复合pH电极为指示电极,手动操作,用自动电位滴定仪记录滴定过程中的电位值。
NaOH标准溶液滴定硫酸铵分析试液,以复合pH电极为指示电极,手动操作,用自动电位滴定仪记录滴定过程中的电位值。
③测定硫酸铵中氮的含量。
将pH/mV开关置“mV”,“设置”开关置“终点”,调节“终点电位”至前面所确定的电位处;然后“设置”开关置“预控点”,调节“预控点”电位器,使仪器显示电位小于预控点电位10mV。取25.00mL硫酸铵分析试液并放于100mL小烧杯中,加5mL蒸馏水,加入磁子,插入电极,放于磁力搅拌器上,开动搅拌;将“功能开关”置“自动”,按下“滴定开始”开关,自动滴定开始(以0.09759 NaOH标准溶液滴定);待“终点”灯亮后,读取NaOH标准溶液消耗体积,平行测定4份。
NaOH标准溶液滴定);待“终点”灯亮后,读取NaOH标准溶液消耗体积,平行测定4份。
(4)硫酸铵中, 的空间结构是
的空间结构是___________ ;滴定管在使用前需要___________ 、洗涤、润洗。
(5)硫酸铵中氮的含量为___________ (保留四位有效数字)。

回答下列问题:硫酸铵晶体的制备。
(1)实验室制备、收集较纯净
 ,下图所示装置正确的连接顺序是
,下图所示装置正确的连接顺序是 的作用是
的作用是
(2)加入过量铁粉的目的是
(3)操作3是指
电位滴定法测定硫酸铵中氮的含量。
①硫酸铵分析试液的配制。
准确称量1.458g硫酸铵晶体,放入100mL小烧杯中,加蒸馏水溶解后定容于250mL容量瓶中待用。
②滴定终点电位的确定。
准确移取25.00mI硫酸铵分析试液并放于100mL小烧杯中,加5mL蒸馏水,加入磁子,插入电极,放于磁力搅拌器上,开动搅拌,用0.09759
 NaOH标准溶液滴定硫酸铵分析试液,以复合pH电极为指示电极,手动操作,用自动电位滴定仪记录滴定过程中的电位值。
NaOH标准溶液滴定硫酸铵分析试液,以复合pH电极为指示电极,手动操作,用自动电位滴定仪记录滴定过程中的电位值。③测定硫酸铵中氮的含量。
将pH/mV开关置“mV”,“设置”开关置“终点”,调节“终点电位”至前面所确定的电位处;然后“设置”开关置“预控点”,调节“预控点”电位器,使仪器显示电位小于预控点电位10mV。取25.00mL硫酸铵分析试液并放于100mL小烧杯中,加5mL蒸馏水,加入磁子,插入电极,放于磁力搅拌器上,开动搅拌;将“功能开关”置“自动”,按下“滴定开始”开关,自动滴定开始(以0.09759
 NaOH标准溶液滴定);待“终点”灯亮后,读取NaOH标准溶液消耗体积,平行测定4份。
NaOH标准溶液滴定);待“终点”灯亮后,读取NaOH标准溶液消耗体积,平行测定4份。| 测定序号 | 1 | 2 | 3 | 4 |
| NaOH标准溶液消耗体积(mL) | 22.61 | 22.68 | 22.59 | 22.60 |
(4)硫酸铵中,
 的空间结构是
的空间结构是(5)硫酸铵中氮的含量为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
【推荐2】实验探究盐A(含3种元素)的组成和性质,假设所有试剂均恰好完全反应,气体体积在标准状况下测定。
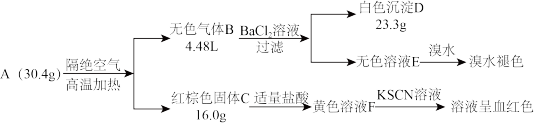
(1)无色气体B有两种非金属氧化物混合组成,其成分为_______ (用化学式表示)。
(2)A高温分解的化学方程式_______ 。
(3)无色溶液E与溴水反应化学方程式_______ 。
(4)黄色溶液F与KSCN反应的离子方程式_______ 。
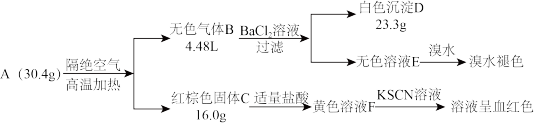
(1)无色气体B有两种非金属氧化物混合组成,其成分为
(2)A高温分解的化学方程式
(3)无色溶液E与溴水反应化学方程式
(4)黄色溶液F与KSCN反应的离子方程式
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
真题
解题方法
【推荐3】磷矿石主要以磷酸钙[Ca3(PO4)2·H2O]和磷灰石[Ca5(OH)(PO4)3]等形式存在。图(a)为目前国际上磷矿石利用的大致情况,其中湿法磷酸是指磷矿石用过量硫酸分解制备磷酸。图(b)是热法磷酸生产过程中由磷灰石制单质磷的流程。

部分物质的相关性质如下:
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的___________ %。
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:___________ 。现有1吨折合含有五氧化二磷约30%的磷灰石,最多可制得85℅的商品磷酸___________ 吨。
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是:___________ (填化学式)。冷凝塔1的主要沉积物是:___________ ,冷凝塔2的主要沉积物是:___________ 。
(4)尾气中主要含有___________ ,还含有少量PH3、H2S和HF等,将尾气先通入纯碱溶液,可除去___________ ,再通入次氯酸钠溶液,可除去___________ (均填化学式)。
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:___________ 。

部分物质的相关性质如下:
| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,具有还原性 |
| SiF4 | -90 | -86 | 易水解 |
回答下列问题:
(1)世界上磷矿石最主要的用途是生产含磷肥料,约占磷矿石使用量的
(2)以磷灰石为原料,湿法磷酸过程中Ca5F(PO4)3反应的化学方程式为:
(3)如图(b)所示,热法生产磷酸的第一步是将二氧化硅、过量焦炭与磷灰石混合,高温反应生成白磷。炉渣的主要成分是:
(4)尾气中主要含有
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但优点是:
您最近一年使用:0次



