常温下,将pH=3的HA溶液V1mL与pH=11的NaOH溶液V2mL混合,则下列说法不正确的是
| A.若反应后溶液呈酸性,则V1一定大于V2 |
| B.若V1=V2,反应后溶液的PH可能等于7 |
| C.若反应后溶液呈中性,则c(H+)+c(OH-)=2×10-7mol/L |
| D.若反应后溶液呈碱性,则V1一定小于V2 |
更新时间:2022-12-03 18:00:59
|
【知识点】 酸碱混合时的定性判断及计算解读
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】25℃时,将0.0l mol • L -1 NaOH溶液滴入20mL0.01mol·L-1CH3COOH溶液的过程中,溶液中由水电离出的c(H+)与加入NaOH溶液体积的关系如图所示。下列说法正确的是
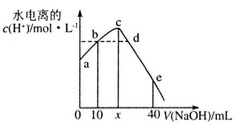
| A.x=20,a点的纵坐标为1.0×10-12 |
| B.b点和d点所示溶液的pH相等 |
| C.滴定过程中,c(CH3COO-)与c(OH-)的比值逐渐增大 |
| D.e点所示溶液中,c(Na+)=2c(CH3COO-)+2c(CH3COOH) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐2】下列说法正确的是
| A.常温下将等体积pH =3的H2SO4和pH =11的碱BOH溶液混合,所得溶液不可能为酸性 |
| B.两种醋酸溶液的pH分别为a和(a+l),物质的量浓度分别为c1和c2,则c1=10c2 |
| C.常温下将0.1mol/L的HI溶液加水稀释100倍,溶液中所有离子的浓度随之减小 |
D. 浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,各溶液浓度大小顺序:③>②>① 浓度相同的下列溶液:①(NH4)2Fe(SO4)2 ②(NH4)2CO3 ③(NH4)2SO4,各溶液浓度大小顺序:③>②>① |
您最近一年使用:0次



