为解决能源短缺问题,工业生产中应合理利用化学能。
(1)实验室用50mL 0.5mol/L的盐酸和50mL 0.55mol/L的NaOH(密度均为1g/cm3)测定中和热。反应前两溶液的温度均为25.2℃,混合后混合溶液的最高温度为28.2℃,反应溶液的比热容为C=4.18J/(g·℃),请写出该反应的热化学方程式_______ 。
(2)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水放出572kJ的热量,则H2的燃烧热 的热化学方程式为_______ 。
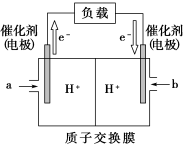
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从_______ 处通入(填“a”或“b”),电池内部H+向_______ (填“左”或“右”)移动。写出电池负极的电极反应式_______ 。
(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
已知:N2(g)+3H2(g)=2NH3(g) ΔH=-93kJ·mol-1.试根据表中所列键能数据计算a的数值_______ 。
(5)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的ΔH=_______ 。
(1)实验室用50mL 0.5mol/L的盐酸和50mL 0.55mol/L的NaOH(密度均为1g/cm3)测定中和热。反应前两溶液的温度均为25.2℃,混合后混合溶液的最高温度为28.2℃,反应溶液的比热容为C=4.18J/(g·℃),请写出该反应的热化学方程式
(2)25℃,1.01×105Pa时,实验测得,4g氢气在O2中完全燃烧生成液态水放出572kJ的热量,则H2的
(3)下图是某笔记本电脑使用的甲醇燃料电池的结构示意图。放电时甲醇应从

(4)从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。
| 化学键 | H—H | N—H | N≡N |
| 键能/kJ·mol-1 | 436 | a | 945 |
已知:N2(g)+3H2(g)=2NH3(g) ΔH=-93kJ·mol-1.试根据表中所列键能数据计算a的数值
(5)已知:C(s,石墨)+O2(g)=CO2(g) ΔH1=-393.5kJ·mol-1①
2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6kJ·mol-1②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1③
根据盖斯定律,计算反应2C(s,石墨)+H2(g)=C2H2(g)的ΔH=
更新时间:2022-12-21 23:41:53
|
相似题推荐
填空题
|
适中
(0.65)
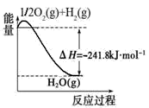
【推荐1】Ⅰ.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ/mol表示。请认真观察图象,然后回答问题。
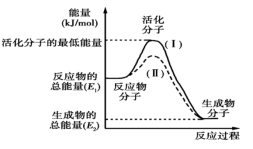
(1)图中所示反应是_______ (填“吸热”或“放热”)反应,该反应的ΔH=_______ (用含E1、E2的代数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是_______ (填代号)。
a.盐酸与NaOH反应
b.Na与H2O反应生成H2
c.铝热反应
d.高温煅烧石灰石
Ⅱ.按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的热化学方程式为_______
(2)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热的热化学方程式为_______
(3)已知N2(g) + 2O2(g) = 2NO2(g);∆H=+67.7KJ/mol,
N2H4(g) + O2(g) = N2(g)+2H2O(g);∆H= -534KJ/mol,
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为_______
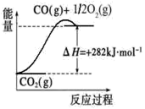
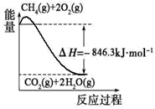
(4)可以甲烷为原料制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。有关化学反应的能量变化如图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______

(1)图中所示反应是
(2)下列4个反应中,符合示意图描述的反应的是
a.盐酸与NaOH反应
b.Na与H2O反应生成H2
c.铝热反应
d.高温煅烧石灰石
Ⅱ.按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O2中完全燃烧生成液态水,放出572 kJ的热量,则H2的燃烧热的热化学方程式为
(2)1.00 L 1.00 mol·L-1H2SO4溶液与2.00 L 1.00 mol·L-1NaOH溶液完全反应,放出114.6 kJ热量,该反应的中和热的热化学方程式为
(3)已知N2(g) + 2O2(g) = 2NO2(g);∆H=+67.7KJ/mol,
N2H4(g) + O2(g) = N2(g)+2H2O(g);∆H= -534KJ/mol,
则N2H4(g)与NO2(g)完全反应生成N2(g)和H2O(g)的热化学方程式为
(4)可以甲烷为原料制得:CH4(g)+H2O(g)⇌CO(g)+3H2(g)。有关化学反应的能量变化如图所示。CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为



您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】某实验小组设计用0.55mol/L的NaOH溶液50mL与0.50mol/L的盐酸50mL置于如图所示的装置中进行测定中和热的实验。

(1)该装置中缺少的一种玻璃仪器是_______ ,该仪器的作用是_______ 。
(2)实验中,所用NaOH稍过量的原因是_______ 。
(3)在中和热测定实验中,有用水洗涤温度计上的盐酸溶液的步骤,若无此操作,则测得的中和热数值_______ (填“偏大”、“偏小”或“不变”)。测量NaOH溶液温度时,温度计上的碱未用水冲洗,对测定结果有何影响?_______ (填“偏大”、“偏小”或“无影响”)。
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如表原始数据:
已知盐酸、NaOH溶液密度均近似为1.00g/cm3,中和后混合液的比热容c=4.18×10−3kJ/(g·℃),则该反应的中和热ΔH=_______ 。(保留到小数点后1位)

(1)该装置中缺少的一种玻璃仪器是
(2)实验中,所用NaOH稍过量的原因是
(3)在中和热测定实验中,有用水洗涤温度计上的盐酸溶液的步骤,若无此操作,则测得的中和热数值
(4)该实验小组做了三次实验,每次取盐酸和NaOH溶液各50mL,并记录如表原始数据:
| 实验序号 | 起始温度t1/℃ | 终止温度t2/℃ | 温差(t2−t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
| 2 | 25.1 | 28.1 | 25.1 | 30.5 | 5.4 |
| 3 | 25.1 | 25.1 | 25.1 | 28.6 | 3.5 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】填空
(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式:_______ 。
(2)在微生物作用的条件下, 经过两步反应被氧化成
经过两步反应被氧化成 。这两步的能量变化如图:
。这两步的能量变化如图:

写出1mol (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为________
(3)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(1) ΔH=-xkJ·mol-1。蒸发1molH2O(1)需要吸收的能量为44kJ,其他相关数据如表:
则表中z的大小为_______ (用含x、a、b、d的代数式表示)。
(4)实验室用50mL0.25mol/L硫酸和50mL0.55mol/LNaOH溶液进行中和热的测定实验,测定数据如下:
设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J/(g·℃),请根据实验数据求出中和热为ΔH=_______ kJ/mol(保留一位小数)
(1)火箭推进器中装有还原剂肼(N2H4)和强氧化剂过氧化氢(H2O2),当它们混合时,即产生大量氮气和水蒸气,并放出大量热。已知0.4mol液态肼与足量的液态过氧化氢反应,生成氮气和水蒸气,放出256kJ的热量。写出该反应的热化学方程式:
(2)在微生物作用的条件下,
 经过两步反应被氧化成
经过两步反应被氧化成 。这两步的能量变化如图:
。这两步的能量变化如图:
写出1mol
 (aq)全部氧化成
(aq)全部氧化成 (aq)的热化学方程式为
(aq)的热化学方程式为(3)已知4NH3(g)+5O2(g)=4NO(g)+6H2O(1) ΔH=-xkJ·mol-1。蒸发1molH2O(1)需要吸收的能量为44kJ,其他相关数据如表:
| 物质 | NH3(g) | O2(g) | NO(g) | H2O(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/kJ | a | b | z | d |
则表中z的大小为
(4)实验室用50mL0.25mol/L硫酸和50mL0.55mol/LNaOH溶液进行中和热的测定实验,测定数据如下:
| 温度 实验次数 | 起始温度t1/℃ | 终止温度t/℃ | ||
| H2SO4 | NaOH | 平均值 | ||
| 1 | 25.0 | 25.2 | 25.1 | 28.5 |
| 2 | 24.9 | 25.1 | 25.0 | 28.3 |
| 3 | 25.6 | 25.4 | 25.5 | 29.0 |
设溶液的密度均为1g·cm-3,中和后溶液的比热容c=4.18J/(g·℃),请根据实验数据求出中和热为ΔH=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】回答下列问题
(1)已知:
则2H2(g)+O2(g) =2H2O(g) ΔH=___________ kJ·mol-1。
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

①N2(g)+O2(g) =2NO(g) ΔH1=___________
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:___________ 。
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。
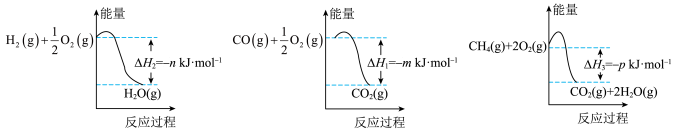
CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为___________ 。
(4)下图是锌锰干电池基本构造图,
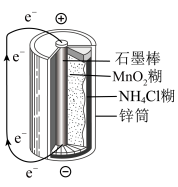
该电池的负极材料是___________ ,工作时NH 在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是___________ ;电路中每通过0.2 mol e-,负极质量减少___________ 。
(1)已知:
| 化学键 | H-H | O=O | O-H |
| 键能(kJ·mol-1) | 436 | 496 | 463 |
(2)消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

①N2(g)+O2(g) =2NO(g) ΔH1=
②2CO(g)+O2(g) = 2CO2(g) ΔH2=-565 kJ·mol-1
在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:
(3)CO和H2是工业上最常用的合成气,该合成气的制备方法很多,它们也能合成许多重要的有机物。制备该合成气的一种方法是以CH4和H2O为原料,有关反应的能量变化如图所示。

CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为
(4)下图是锌锰干电池基本构造图,

该电池的负极材料是
 在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
在正极放电产生两种气体,其中一种气体分子是含10e-的微粒,正极的电极反应式是
您最近一年使用:0次
【推荐2】丁二烯是生产合成橡胶的主要原料。一定条件下,2,3-二甲基-1,3-丁二烯(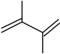 )与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:
)与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:
①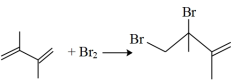
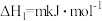
②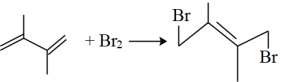

③

已知体系中两种产物可通过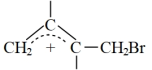 互相转化,反应历程及能量变化如下图所示:
互相转化,反应历程及能量变化如下图所示:
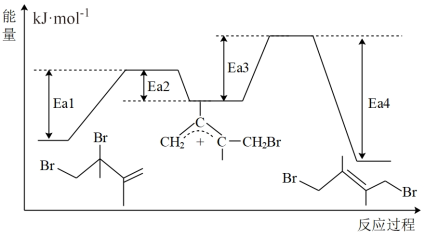
(1)由反应过程及能量变化图示判断,m___________ n(填“>”、“=”或“<”),
___________  (用含
(用含 、
、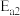 、
、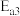 、
、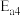 的式子表示)
的式子表示)
(2)由反应过程及能量变化图示判断,反应___________ (填“①”、“②”)的产物更稳定,若要提高该产物在平衡体系中的物质的量分数,还可采取的措施是___________ 。
(3)在一定温度下,向某反应容器中加入1.0mol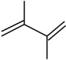 和一定量的
和一定量的 发生上述反应。测得
发生上述反应。测得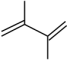 的平衡转化率为a,平衡时
的平衡转化率为a,平衡时 为bmol,若以物质的量分数表示的平衡常数
为bmol,若以物质的量分数表示的平衡常数 ,反应③的平衡常数
,反应③的平衡常数 ,则产物
,则产物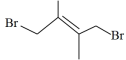 的选择性百分比为
的选择性百分比为___________ (选择性是指目标产物在最终产物中的比率),开始加入的 的物质的量为
的物质的量为___________ mol,反应①的平衡常数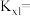
___________ 。
 )与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:
)与溴单质发生液相加成反应(1,2加成和1,4加成),已知溶剂极性越大越容易发生1,4加成。现体系中同时存在如下反应:①

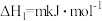
②
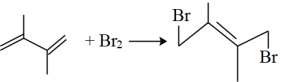

③


已知体系中两种产物可通过
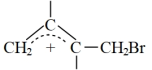 互相转化,反应历程及能量变化如下图所示:
互相转化,反应历程及能量变化如下图所示:
(1)由反应过程及能量变化图示判断,m

 (用含
(用含 、
、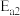 、
、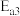 、
、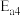 的式子表示)
的式子表示)(2)由反应过程及能量变化图示判断,反应
(3)在一定温度下,向某反应容器中加入1.0mol
 和一定量的
和一定量的 发生上述反应。测得
发生上述反应。测得 的平衡转化率为a,平衡时
的平衡转化率为a,平衡时 为bmol,若以物质的量分数表示的平衡常数
为bmol,若以物质的量分数表示的平衡常数 ,反应③的平衡常数
,反应③的平衡常数 ,则产物
,则产物 的选择性百分比为
的选择性百分比为 的物质的量为
的物质的量为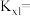
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】煤的气化技术发展较早,近几年来煤的气化技术更多的倾向于用水煤浆与粉煤为原料的加压气化技术。煤的气化的流程示意图如下:
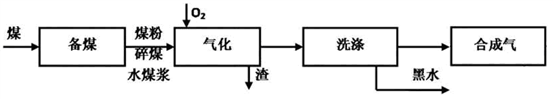
(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g) CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol
②2CO(g)+O2(g) 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol
③2H2(g)+O2(g) 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol
写出利用水煤浆生产水煤气的热化学方程式___________________ 。
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示: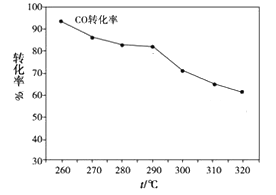
①合成二甲醚的化学方程式为___________________________
②其中CO的转化率随温度的升高而降低的原因_________________ 。
③有利于该反应充分进行的条件是______________ (填字母)
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了________ 因素
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。
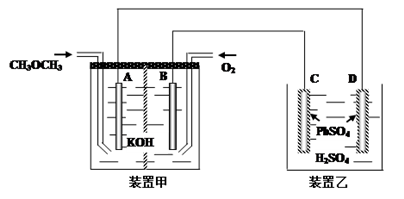
① 写出甲装置中B极的电极反应____________________________
② 写出乙装置中D极的电极反应式___________________________
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为____ mol

(1)煤的气化过程中,存在如下反应:
① C(s)+O2(g)
 CO2(g) △H1=-394.1kJ/mol
CO2(g) △H1=-394.1kJ/mol②2CO(g)+O2(g)
 2CO2(g) △H2=-566.0kJ/mol
2CO2(g) △H2=-566.0kJ/mol③2H2(g)+O2(g)
 2H2O(g) △H3=-483.6kJ/mol
2H2O(g) △H3=-483.6kJ/mol写出利用水煤浆生产水煤气的热化学方程式
(2)一定条件下,由H2和CO可直接制备二甲醚(CH3OCH3)(产物中还有水蒸气),结果如图所示:

①合成二甲醚的化学方程式为
②其中CO的转化率随温度的升高而降低的原因
③有利于该反应充分进行的条件是
a.高温低压 b.低温高压 c.高温高压 d.低温低压
④在实际生产中选择了适宜温度和压强,原因是考虑了
(3)图中,甲装置为CH3OCH3碱性燃烧电池,其电极均为Pt电极。装置乙中,C、D电极为Pb电极,其表面均覆盖着PbSO4,其电解液为稀H2SO4溶液。

① 写出甲装置中B极的电极反应
② 写出乙装置中D极的电极反应式
③ 当有46克二甲醚参加反应时,电路中通过的电子的物质的量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】在等压下化学反应所吸收或放出的热量,称为化学反应的焓变。回答下列问题:
(1)25℃、 时,
时, 氨气完全燃烧放出
氨气完全燃烧放出 的热量,则
的热量,则

___________  。
。
(2) 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。

已知: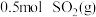 被氧化为
被氧化为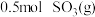 的
的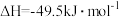 。则:
。则:
①E的大小对该反应的反应热___________ (填“有”或“无”)影响;该反应通常用 作催化剂,加
作催化剂,加 会使图中B点
会使图中B点___________ (填“升高”或“降低”)。
② 氧化为
氧化为 的热化学方程式为
的热化学方程式为___________ 。
(3)已知拆开 键、
键、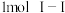 、
、 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、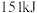 、
、 。则由氢气和碘反应生成
。则由氢气和碘反应生成 需要
需要___________ (填“放出”或“吸收”)___________  的热量。
的热量。
(4)发射卫星时可用肼( )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
已知:①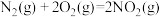
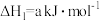
②

写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:___________ 。
(1)25℃、
 时,
时, 氨气完全燃烧放出
氨气完全燃烧放出 的热量,则
的热量,则

 。
。(2)
 反应过程的能量变化如图所示。
反应过程的能量变化如图所示。
已知:
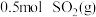 被氧化为
被氧化为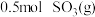 的
的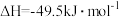 。则:
。则:①E的大小对该反应的反应热
 作催化剂,加
作催化剂,加 会使图中B点
会使图中B点②
 氧化为
氧化为 的热化学方程式为
的热化学方程式为(3)已知拆开
 键、
键、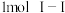 、
、 键分别需要吸收的能量为
键分别需要吸收的能量为 、
、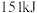 、
、 。则由氢气和碘反应生成
。则由氢气和碘反应生成 需要
需要 的热量。
的热量。(4)发射卫星时可用肼(
 )为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。
)为燃料,用二氧化氮为氧化剂,这两种物质反应生成氮气和水蒸气。已知:①
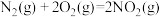
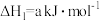
②


写出肼和二氧化氮反应生成氮气和气态水的热化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】生产生活中的化学反应都伴随能量的变化,请回答下列问题。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用___________ (填“放热”或“吸热”)的化学变化或物理变化。
(2)天然气中含有的微量 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。
写出该反应的热化学方程式:___________
(3)汽车尾气中排放的 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:
Ⅰ.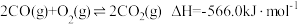
Ⅱ.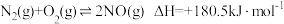
Ⅲ.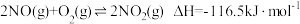
① 的燃烧热为
的燃烧热为___________  。
。
② 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为___________ 。
③下图是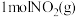 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是___________ (填“增大”、“减小”或“不变”,下同), 的变化是
的变化是___________ 。


(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为___________ 。
②在操作正确的前提下,提高中和热测定准确性的关键是___________ 。
(1)冷敷袋在日常生活中有降温、保鲜和镇痛等用途,制作冷敷袋可以利用
(2)天然气中含有的微量
 会腐蚀管道和设备,在
会腐蚀管道和设备,在 下进行脱硫处理,
下进行脱硫处理, 会被氧气氧化为
会被氧气氧化为 ,并产生水蒸气。
,并产生水蒸气。| 化学键 | 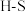 |  |  |  中共价键 中共价键 |
键能/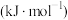 | 339 | 498 | 464 | 1083 |
写出该反应的热化学方程式:
(3)汽车尾气中排放的
 和
和 会污染环境,在汽车尾气系统中装置催化转化器,可有效降低
会污染环境,在汽车尾气系统中装置催化转化器,可有效降低 和
和 的排放。已知:
的排放。已知:Ⅰ.
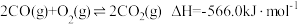
Ⅱ.
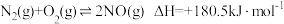
Ⅲ.
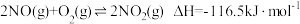
①
 的燃烧热为
的燃烧热为 。
。②
 将
将 还原为单质的热化学方程式为
还原为单质的热化学方程式为③下图是
 和
和 反应生成
反应生成 和
和 过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大,
过程中的能量变化示意图,若在反应体系中加入催化剂,反应速率增大, 的变化是
的变化是 的变化是
的变化是

(4)实验室利用如上图装置进行中和热的测定。
①图中还缺少一个玻璃仪器,名称为
②在操作正确的前提下,提高中和热测定准确性的关键是
您最近一年使用:0次
【推荐3】
(1)已知:N2(g)+3H2(g) 2NH3(g)ΔH=﹣92.4 kJ•
2NH3(g)ΔH=﹣92.4 kJ• ,
,
2H2(g)+O2(g)=2H2O(l)ΔH=﹣571.6 kJ• ,
,
则2N2(g)+6H2O(l) 4NH3(g)+3O2(g) ΔH=
4NH3(g)+3O2(g) ΔH=_______ 。
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:
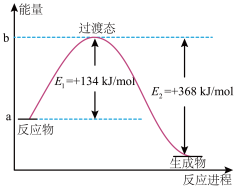
上图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出CO2和NO反应生成NO2和CO的热化学方程式:__________________________________ 。在反应体系中加入催化剂,E1和E2的变化是:E1__ ,E2__ (填“增大”“减小”或“不变”),对反应热是否有影响?__ (填“是”或“否”),原因是________________________________________ 。
(3)常温常压下断裂1 mol气体分子化学键所吸收的能量或形成1 mol气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):请完成下列问题。
热化学方程式2H2(g)+S2(g)=2H2S(g) ΔH=-229 kJ·mol-1,则X=________ 。
(1)已知:N2(g)+3H2(g)
 2NH3(g)ΔH=﹣92.4 kJ•
2NH3(g)ΔH=﹣92.4 kJ• ,
,2H2(g)+O2(g)=2H2O(l)ΔH=﹣571.6 kJ•
 ,
,则2N2(g)+6H2O(l)
 4NH3(g)+3O2(g) ΔH=
4NH3(g)+3O2(g) ΔH=(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量过渡态。分析图中信息,回答下列问题:

上图是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出CO2和NO反应生成NO2和CO的热化学方程式:
(3)常温常压下断裂1 mol气体分子化学键所吸收的能量或形成1 mol气体分子化学键所放出的能量称为键能(单位为kJ·mol-1)。下表是一些键能数据(kJ·mol-1):请完成下列问题。
H—H | 436 | S=S | X | H—S | 339 |
热化学方程式2H2(g)+S2(g)=2H2S(g) ΔH=-229 kJ·mol-1,则X=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】如图所示的装置,X、Y都是惰性电极。将电路接通电极后,向乙中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:
(1)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是___________ (填“CH4”或“O2”),电极上发生的电极反应是___________ 。
(2)如果丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的CH4的质量为___________ 。

(1)甲装置是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图,则a处通入的是
(2)如果丙装置中精铜电极的质量增加了6.4g,则甲装置中消耗的CH4的质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
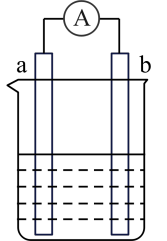
(1)当电极 a 为 Al,电极 b 为 Cu,电解质溶液为浓硝酸时,该电池的 负极为_________ (填“Al”或“Cu”),正极的电极反应式为___________ 。
(2)当电极 a 为 Al,电极 b 为 Mg,电解质溶液为氢氧化钠溶液时,该 电池负极的电极反应式为_____ ,当反应中收集到标准状况下 224 mL 气体时,消耗的电极质量为_____ g。
(3)燃料电池的工作原理是将燃料和氧化剂(如 O2)反应所产生的能量直接转化为电能。现设计一种燃料电池,以对气体吸附能力很强的 Pt 作为两个电极,甲烷为燃料,采用氢氧化钠溶液 为电解质溶液,则通甲烷的电极为_____ 极(填“正”或“负”),该电池正极的电极反应式 为_____ ,该电池工作一段时间后,溶液中 OH-的浓度将_____ (填“增 大”、“减小”或“不变”)。

(1)当电极 a 为 Al,电极 b 为 Cu,电解质溶液为浓硝酸时,该电池的 负极为
(2)当电极 a 为 Al,电极 b 为 Mg,电解质溶液为氢氧化钠溶液时,该 电池负极的电极反应式为
(3)燃料电池的工作原理是将燃料和氧化剂(如 O2)反应所产生的能量直接转化为电能。现设计一种燃料电池,以对气体吸附能力很强的 Pt 作为两个电极,甲烷为燃料,采用氢氧化钠溶液 为电解质溶液,则通甲烷的电极为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
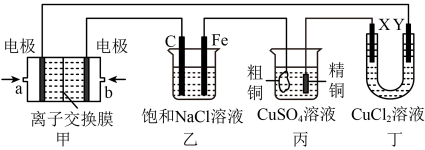
【推荐3】如图所示,某同学设计了一个燃料电池探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜,请按要求回答相关问题:
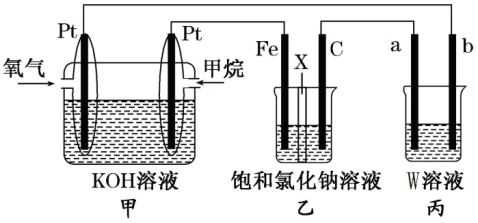
(1)石墨电极(C)作___________ 极,甲中甲烷燃料电池的负极反应式为___________ 。
(2)若消耗2.24(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为___________ L。
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是___________
(4)若丙中以稀H2SO4为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜,该电极反应式为___________ 。
(5)若将乙装置中两电极用导线直接相连形成原电池,则石墨(C)电极上发生的电极反应为:___________ 。

(1)石墨电极(C)作
(2)若消耗2.24(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为
(3)若丙中以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是___________
| A.a电极为纯铜 | B.粗铜接电源正极,发生还原反应 |
| C.CuSO4溶液的浓度保持不变 | D.利用阳极泥可回收Ag、Pt、Au等金属 |
(5)若将乙装置中两电极用导线直接相连形成原电池,则石墨(C)电极上发生的电极反应为:
您最近一年使用:0次



