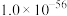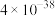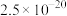市售的高锰酸钾常含有少量杂质。KMnO4是强氧化剂,在水溶液中能自行分解,其分解反应为:4KMnO4+2H2O=4MnO2↓+4KOH+3O2↑,分解速率随溶液的pH而变化,反应原理为4MnO +12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。
+12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。
Ⅰ.KMnO4溶液的配制
称取1.600gKMnO4溶于盛有500mL水的烧杯中,加热煮沸20-30min,并在水浴上保温1h,冷却后过滤,储存于洁净试剂瓶中。
Ⅱ.KMnO4溶液的标定(标定:使用标准物测出某溶液的精确浓度的过程)
准确称取Na2C2O40.200g置于250mL锥形瓶中,加入蒸馏水40mL及3.000mol·L-1硫酸溶液10mL,加热至75-85℃(不可煮沸)立即用待标定的KMnO4溶液滴定。开始滴定时反应速率慢,应逐滴加入,当加入第一滴KMnO4溶液颜色褪去后再加入第二滴,待溶液中产生Mn2+后,滴定速度可加快。达滴定终点,记录消耗KMnO4溶液的体积。
平行测定3次,体积的平均值为29.85mL。
回答下列问题:
(1)滴定时使用_________ 式滴定管。
(2)为延长储存时间,配制的KMnO4溶液应呈_________ 性,且存放方法是_________ 。配制过程中,加热煮沸且冷却后过滤的目的是_________ 。
(3)用离子方程式表示标定反应的反应原理_________ 。
(4)开始滴定时滴加KMnO4溶液的速度不宜太快,否则会导致测定结果_________ (填“偏高”或“偏低”)。
(5)达滴定终点的判定依据是_________ 。
(6)经计算,所配制的KMnO4溶液的物质的量浓度为_________ (保留小数点后两位)
 +12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。
+12H+=4Mn2++5O2↑+6H2O。在中性溶液中分解很慢,但Mn2+和MnO2能加速KMnO4的分解,见光则分解更快。Ⅰ.KMnO4溶液的配制
称取1.600gKMnO4溶于盛有500mL水的烧杯中,加热煮沸20-30min,并在水浴上保温1h,冷却后过滤,储存于洁净试剂瓶中。
Ⅱ.KMnO4溶液的标定(标定:使用标准物测出某溶液的精确浓度的过程)
准确称取Na2C2O40.200g置于250mL锥形瓶中,加入蒸馏水40mL及3.000mol·L-1硫酸溶液10mL,加热至75-85℃(不可煮沸)立即用待标定的KMnO4溶液滴定。开始滴定时反应速率慢,应逐滴加入,当加入第一滴KMnO4溶液颜色褪去后再加入第二滴,待溶液中产生Mn2+后,滴定速度可加快。达滴定终点,记录消耗KMnO4溶液的体积。
平行测定3次,体积的平均值为29.85mL。
回答下列问题:
(1)滴定时使用
(2)为延长储存时间,配制的KMnO4溶液应呈
(3)用离子方程式表示标定反应的反应原理
(4)开始滴定时滴加KMnO4溶液的速度不宜太快,否则会导致测定结果
(5)达滴定终点的判定依据是
(6)经计算,所配制的KMnO4溶液的物质的量浓度为
更新时间:2022-12-09 09:50:26
|
【知识点】 氧化还原原理滴定
相似题推荐
解答题-实验探究题
|
适中
(0.65)
【推荐1】在工业生产中,硫酸亚铁铵晶体[(NH4)2Fe(SO4)2•6H2O]具有十分广泛的用途。实验室拟用FeSO4溶液与(NH4)2SO4溶液反应制备硫酸亚铁铵晶体,并测定其纯度。
已知:①铁粉中含有少量FeS杂质;②FeSO4溶液易被氧化;③硫酸亚铁铵晶体易溶于水,不溶于乙醇,在空气中不易被氧化。
实验一:制备硫酸亚铁铵晶体,其装置如图(夹持仪器已略去)。
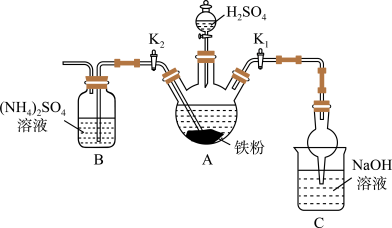
(1)先关闭旋塞K2,打开旋塞K1,再打开分液漏斗活塞使H2SO4与铁屑反应,此时产生氢气的作用是______ 。
(2)反应一段时间后,关闭旋塞K1,打开旋塞K2,持续产生氢气的作用是______ 。
(3)将装置B中制得的溶液蒸发浓缩、______ 、过滤、用乙醇洗涤,即可得到硫酸亚铁铵晶体。
实验二:产品纯度的测定
称取实验一中制取的产品ag溶于稀硫酸中配制成100mL溶液。每次量取20.00mL溶液注入锥形瓶,用0.1000mol•L-1的KMnO4标准溶液滴定,三次消耗KMnO4溶液的读数如表。
(4)用KMnO4溶液滴定时,应将KMnO4溶液注入______ (选填“酸式”或“碱式”)滴定管中
(5)滴定终点时的现象是______ 。
(6)滴定过程中,可能导致产品纯度测定结果偏高的操作是______ 。(填标号)。
(7)假设[(NH4)2Fe(SO4)2•6H2O]相对分子质量为M,则产品中[(NH4)2Fe(SO4)2•6H2O]的质量分数为______ (用含a、M的代数式表示)。
已知:①铁粉中含有少量FeS杂质;②FeSO4溶液易被氧化;③硫酸亚铁铵晶体易溶于水,不溶于乙醇,在空气中不易被氧化。
实验一:制备硫酸亚铁铵晶体,其装置如图(夹持仪器已略去)。

(1)先关闭旋塞K2,打开旋塞K1,再打开分液漏斗活塞使H2SO4与铁屑反应,此时产生氢气的作用是
(2)反应一段时间后,关闭旋塞K1,打开旋塞K2,持续产生氢气的作用是
(3)将装置B中制得的溶液蒸发浓缩、
实验二:产品纯度的测定
称取实验一中制取的产品ag溶于稀硫酸中配制成100mL溶液。每次量取20.00mL溶液注入锥形瓶,用0.1000mol•L-1的KMnO4标准溶液滴定,三次消耗KMnO4溶液的读数如表。
| 滴定次数 | 待测溶液的体积 | KMnO4溶液读数记录(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 20.00mL | 0.20 | 20.20 |
| 第二次 | 20.00mL | 2.20 | 22.20 |
| 第三次 | 20.00mL | 2.00 | 25.00 |
(5)滴定终点时的现象是
(6)滴定过程中,可能导致产品纯度测定结果偏高的操作是
| A.锥形瓶用蒸馏水洗后,再用产品溶液润洗 |
| B.滴定过程中,振荡锥形瓶时部分液体溅出 |
| C.用滴定管量取产品溶液时,开始读数正确,最后俯视读数 |
| D.装KMnO4溶液的滴定管滴定前无气泡,滴定后有气泡 |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
名校
解题方法
【推荐2】某粗铜精炼得到的阳极泥主要成分为:Cu、Se、 等,从中提取Se的工艺流程如下:
等,从中提取Se的工艺流程如下:

已知:
(1)酸浸过程,通入稀硫酸和空气的目的是___________ 。
(2)“氯化”过程中发生如下转化:
①Se转化为 ,反应方程式为
,反应方程式为___________ 。
② 转化为AgCl,从化学平衡的角度解释原因
转化为AgCl,从化学平衡的角度解释原因___________ 。
(3)①“还原”过程中发生反应的化学方程式为___________ 。
② 、
、 、
、 氧化性由强到弱的顺序为
氧化性由强到弱的顺序为___________ 。
(4)滴定法测定 溶液的浓度,其基本原理为:
溶液的浓度,其基本原理为:
第一步:
第二步: (无色)
(无色) (无色)
(无色)
①由此可知滴定所用的指示剂为___________ 。
②若 溶液体积为25mL,滴定至终点时消耗
溶液体积为25mL,滴定至终点时消耗 溶液V mL,则
溶液V mL,则 溶液的物质的量浓度为
溶液的物质的量浓度为___________ mol/L。
③若使用的KI溶液过量,对滴定结果有无影响并简述理由___________ 。
 等,从中提取Se的工艺流程如下:
等,从中提取Se的工艺流程如下:
已知:
| 化学式 |  | AgCl |
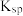 (常温) (常温) |  |  |
(1)酸浸过程,通入稀硫酸和空气的目的是
(2)“氯化”过程中发生如下转化:
①Se转化为
 ,反应方程式为
,反应方程式为②
 转化为AgCl,从化学平衡的角度解释原因
转化为AgCl,从化学平衡的角度解释原因(3)①“还原”过程中发生反应的化学方程式为
②
 、
、 、
、 氧化性由强到弱的顺序为
氧化性由强到弱的顺序为(4)滴定法测定
 溶液的浓度,其基本原理为:
溶液的浓度,其基本原理为:第一步:

第二步:
 (无色)
(无色) (无色)
(无色)
①由此可知滴定所用的指示剂为
②若
 溶液体积为25mL,滴定至终点时消耗
溶液体积为25mL,滴定至终点时消耗 溶液V mL,则
溶液V mL,则 溶液的物质的量浓度为
溶液的物质的量浓度为③若使用的KI溶液过量,对滴定结果有无影响并简述理由
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐3】电子印制工业产生的某退锡废液中含硝酸、锡化合物及少量 和
和 等,对其处理的流程如图。
等,对其处理的流程如图。

①25℃时相关的溶度积见表,② 。
。
(1)退锡工艺是利用稀 与Sn反应生成
与Sn反应生成 ,且无气体生成,则生成的硝酸盐是
,且无气体生成,则生成的硝酸盐是__________ (填化学式),已知废液中的 易转化成
易转化成 。
。
(2)沉淀1的主要成分是 ,焙烧时,与
,焙烧时,与 反应的化学方程式为
反应的化学方程式为__________ 。
(3)滤液1中 和
和 的浓度相近,加入
的浓度相近,加入 溶液调pH,25℃时,为了使
溶液调pH,25℃时,为了使 沉淀完全,需调节溶液pH不小于
沉淀完全,需调节溶液pH不小于__________ 。
(4)称取产品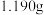 ,用大量盐酸溶解,在
,用大量盐酸溶解,在 保护下,先用Al片将
保护下,先用Al片将 还原为
还原为 ,再用
,再用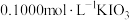 标准溶液滴定,以淀粉作指示剂,滴定过程中
标准溶液滴定,以淀粉作指示剂,滴定过程中 被还原为
被还原为 ,终点时消耗
,终点时消耗 溶液
溶液 。
。
①终点时的现象为__________ 。
②写出滴定的离子反应方程式为__________ 。
③产品中Sn元素的质量分数为__________ 。
(5)某制得的粗锡中主要含有金属Fe、Cu、Pb、Sb常采用电解精炼法获得精锡。其中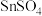 溶液作电解液,精锡连接电源的
溶液作电解液,精锡连接电源的__________ 极。检测可知电解后阳极泥中含有Sb、Cu、 等,则电解过程中阳极电极反应式有
等,则电解过程中阳极电极反应式有 、
、__________ 。
 和
和 等,对其处理的流程如图。
等,对其处理的流程如图。
①25℃时相关的溶度积见表,②
 。
。化学式 |
|
|
|
溶度积 |
|
|
|
(1)退锡工艺是利用稀
 与Sn反应生成
与Sn反应生成 ,且无气体生成,则生成的硝酸盐是
,且无气体生成,则生成的硝酸盐是 易转化成
易转化成 。
。(2)沉淀1的主要成分是
 ,焙烧时,与
,焙烧时,与 反应的化学方程式为
反应的化学方程式为(3)滤液1中
 和
和 的浓度相近,加入
的浓度相近,加入 溶液调pH,25℃时,为了使
溶液调pH,25℃时,为了使 沉淀完全,需调节溶液pH不小于
沉淀完全,需调节溶液pH不小于(4)称取产品
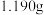 ,用大量盐酸溶解,在
,用大量盐酸溶解,在 保护下,先用Al片将
保护下,先用Al片将 还原为
还原为 ,再用
,再用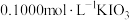 标准溶液滴定,以淀粉作指示剂,滴定过程中
标准溶液滴定,以淀粉作指示剂,滴定过程中 被还原为
被还原为 ,终点时消耗
,终点时消耗 溶液
溶液 。
。①终点时的现象为
②写出滴定的离子反应方程式为
③产品中Sn元素的质量分数为
(5)某制得的粗锡中主要含有金属Fe、Cu、Pb、Sb常采用电解精炼法获得精锡。其中
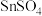 溶液作电解液,精锡连接电源的
溶液作电解液,精锡连接电源的 等,则电解过程中阳极电极反应式有
等,则电解过程中阳极电极反应式有 、
、
您最近一年使用:0次

 或
或