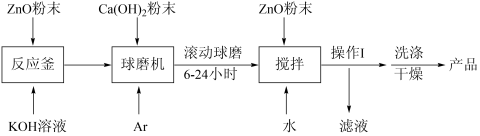
随着人们对电动汽车需求的进一步扩大,高能量、高电流的锌系二次碱性电池受到市场的期待,但是锌电池在充电过程中存在变形、枝晶、腐蚀和钝化等问题,目前采用氢氧化钙处理氧化锌工艺得到锌酸钙作为电极的活性物质,使以上情况得到极大改善。一种锌酸钙的化学式为Ca[Zn(OH)3]2·2H2O,其制备流程如下:
请回答下列问题:
(1)Zn(OH)2是两性氢氧化物,与NaOH反应的方程式为Zn(OH)2+2NaOH=Na2ZnO2+2H2O。ZnO是两性氧化物,则反应釜中发生反应的离子方程式为_______ 。
(2)球磨机是用研磨体摩擦、冲击物料使其研磨成粉末的设备。研磨过程加入Ca(OH)2粉末时,通入Ar的作用是_______ 。
(3)滚动球磨6~24小时的目的是_______ 。
(4)操作I为_______ 。干燥产品时必须在低温减压条件下进行,理由是_______ 。

请回答下列问题:
(1)Zn(OH)2是两性氢氧化物,与NaOH反应的方程式为Zn(OH)2+2NaOH=Na2ZnO2+2H2O。ZnO是两性氧化物,则反应釜中发生反应的离子方程式为
(2)球磨机是用研磨体摩擦、冲击物料使其研磨成粉末的设备。研磨过程加入Ca(OH)2粉末时,通入Ar的作用是
(3)滚动球磨6~24小时的目的是
(4)操作I为
更新时间:2022/12/18 10:29:30
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐1】苯乙酮( )可用作制造香料,可由苯和乙酸酐制备,其反应原理为:
)可用作制造香料,可由苯和乙酸酐制备,其反应原理为:
已知:
请回答下列问题:
Ⅰ.催化剂无水 的制备
的制备
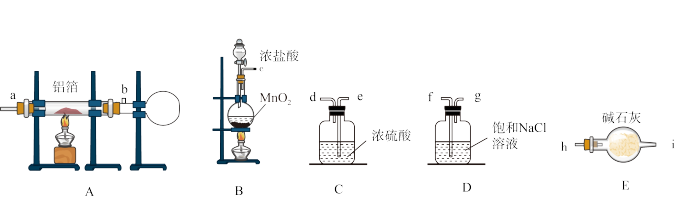
下图是实验室制取并收集少量无水 的相关实验仪器和药品。
的相关实验仪器和药品。
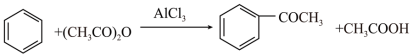
(1)B中发生反应的化学方程式为_______ 。
(2)制备无水 时导管接口顺序为c→
时导管接口顺序为c→_______ (填序号,装置不可重复使用),其中装置E的作用是_______ 。
Ⅱ.苯乙酮的制备
步骤一:向三颈烧瓶中加入14.0g苯和6.0g无水 ,在搅拌下滴加10.2g乙酸酐,在70~80℃下加热45min,反应装置如图(省略部分装置)。
,在搅拌下滴加10.2g乙酸酐,在70~80℃下加热45min,反应装置如图(省略部分装置)。
步骤二:冷却后,将三颈烧瓶中的物质全部倒入25.0g冰水中,有白色胶状沉淀生成;水层用苯萃取,合并苯层溶液,再依次用15mL 5% NaOH溶液和15mL水洗涤,分离出苯层。
步骤三:向苯层中加入无水硫酸镁,放置一段时间后,收集产品苯乙酮并回收苯。

(3)仪器N的名称为_______ ,其作用有:①平衡气压;②_______ 。
(4)步骤二中用NaOH溶液洗涤的目的是_______ 。
(5)实验中制得5.6g苯乙酮,则苯乙酮的产率为_______ %(保留一位小数)。
 )可用作制造香料,可由苯和乙酸酐制备,其反应原理为:
)可用作制造香料,可由苯和乙酸酐制备,其反应原理为:
已知:
| 名称 | 相对分子质量 | 沸点/℃ | 密度( ) ) | 溶解性 |
| 苯 | 78 | 80.1 | 0.88 | 不溶于水,易溶于有机溶剂 |
| 苯乙酮 | 120 | 203 | 1.03 | 微溶于水,易溶于有机溶剂 |
| 乙酸酐 | 102 | 139 | 1.08 | 溶于水生成乙酸,易溶于有机溶剂 |
 | 133.5 | 178(升华) | 2.44 | 遇水易水解 |
Ⅰ.催化剂无水
 的制备
的制备下图是实验室制取并收集少量无水
 的相关实验仪器和药品。
的相关实验仪器和药品。
(1)B中发生反应的化学方程式为
(2)制备无水
 时导管接口顺序为c→
时导管接口顺序为c→Ⅱ.苯乙酮的制备
步骤一:向三颈烧瓶中加入14.0g苯和6.0g无水
 ,在搅拌下滴加10.2g乙酸酐,在70~80℃下加热45min,反应装置如图(省略部分装置)。
,在搅拌下滴加10.2g乙酸酐,在70~80℃下加热45min,反应装置如图(省略部分装置)。步骤二:冷却后,将三颈烧瓶中的物质全部倒入25.0g冰水中,有白色胶状沉淀生成;水层用苯萃取,合并苯层溶液,再依次用15mL 5% NaOH溶液和15mL水洗涤,分离出苯层。
步骤三:向苯层中加入无水硫酸镁,放置一段时间后,收集产品苯乙酮并回收苯。

(3)仪器N的名称为
(4)步骤二中用NaOH溶液洗涤的目的是
(5)实验中制得5.6g苯乙酮,则苯乙酮的产率为
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
名校
解题方法
【推荐2】某油脂厂废弃的油脂加氢镍催化剂(主要含金属Ni、Al、Fe及其氧化物,还有少量其他不溶性物质)。采用如下工艺流程回收其中的镍制备硫酸镍晶体(NiSO4·7H2O):

常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
(1)“碱浸”中NaOH的作用是___________ 。为回收金属,用稀硫酸将“滤液①”调为中性,生成沉淀。写出该反应的离子方程式:___________ 。
(2)“滤液②”中含有的金属离子是Fe3+和___________ 。
(3)“转化”中可替代H2O2的物质是___________ 。若 工艺流程改为先“调pH”后“氧化” ,如图所示,“滤液③”中可能含有的杂质离子为___________ 。

(4)利用上述表格数据,计算Ni(OH)2的Ksp=___________ 。
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:___________ 。
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是___________ 。

常温下,溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
| 金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
| 开始沉淀时(c=0.01 mol∙L−1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
| 沉淀完全时(c=1.0 ×10−5 mol∙L−1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
(2)“滤液②”中含有的金属离子是Fe3+和
(3)“转化”中可替代H2O2的物质是

(4)利用上述表格数据,计算Ni(OH)2的Ksp=
(5)硫酸镍在强碱溶液中用NaClO氧化,可沉淀出能用作镍镉电池正极材料的NiOOH。写出该反应的离子方程式:
(6)将分离出硫酸镍晶体后的母液收集、循环使用,其意义是
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
【推荐3】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,一种生产NaClO2的工艺如下:
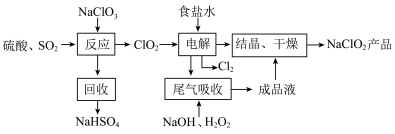
已知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为___ ,该新方法最突出的优点是___ 。
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③___ ;④低于60℃干燥,得到产品。
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度___ 。(提示:2Na2S2O3+I2=Na2S4O6+2Nal)
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。

①酸性条件下NaClO2溶液中存在的Cl-原因是___ (用离子方程式解释)。
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是___ 。

已知:①ClO2是一种强氧化性气体,浓度大时易分解爆炸。在生产使用时要用稀有气体或空气等进行稀释,同时避免光照、震动等。②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。回答下列问题:
(1)最近科学家又在“反应”步骤的基础上研究出用H2C2O4代替SO2制备ClO2的新方法,该方法的化学方程式为
(2)获得产品NaClO2的“操作”包括以下步骤:
①减压,55℃蒸发结晶;②趁热过滤;③
(3)为了测定产品NaClO2的纯度,取上述所得产品12.5g溶于水配成1L溶液,取出10.00mL溶液于锥形瓶中,再加入足量酸化的KI溶势、充分反应后(ClO2-被还原为Cl-,杂质不参加反应),加入2~3滴淀粉溶液,用0.25mol·L-1Na2S2O3标准液滴定,达到滴定终点时用去标准液20.00mL,试计算产品NaClO2的纯度
(4)NaClO2溶液中存在ClO2、HClO2、ClO2-、Cl-四种含氯微粒。经测定25℃各含氯微粒浓度随pH的变化情况如图所示(Cl-没有画出)。

①酸性条件下NaClO2溶液中存在的Cl-原因是
②pH=5时,NaClO2溶液中ClO2、HClO2、ClO2-、Cl-四种含氯微粒的浓度由大到小的顺序是
您最近半年使用:0次



