利用甲烷还原SO2可以减轻环境污染,实现硫的回收。
已知:①甲烷的燃烧热为890kJ•mol﹣1;
②S(s)+O2(g)=SO2(g)△H=﹣216kJ•mol﹣1
③H2O(1)=H2O(g)△H=+44kJ•mol﹣1
(1)CH4(g)+2SO2(g) 2S(s)+CO2(g)+2H2O(g) △H=
2S(s)+CO2(g)+2H2O(g) △H=_______ 。
(2)某温度下,向容积为2L的密闭容器中充入1.0molCH4和2.0molSO2,发生反应CH4(g)+2SO2(g) 2S (s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
2S (s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
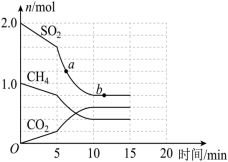
①反应开始至达到平衡时,平均反应速率v(H2O)=_______ ;该温度下,该反应的平衡常数K=_______ 。
②5min时,改变的外界条件可能是_______ (填字母)。
A.升高温度 B.降低温度 C.加入催化剂 D.充入CH4(g)
(3)一定温度下,向某密容器中充入一定量的CH4和SO2发生反应CH4(g)+2SO2(g) 2S(s)+CO2(g)+2H2O(g)。
2S(s)+CO2(g)+2H2O(g)。
①若该容器容积恒定,则下列物理量不再改变时,一定能说明反应达到平衡状态的是_______ (填字母)。
A.m(S) B.
C.CH4和CO2的浓度之和 D.容器中气体的密度
②该温度下,欲提高SO2的平衡转化率,可采取的措施有_______ (任答两条,下同);
已知:①甲烷的燃烧热为890kJ•mol﹣1;
②S(s)+O2(g)=SO2(g)△H=﹣216kJ•mol﹣1
③H2O(1)=H2O(g)△H=+44kJ•mol﹣1
(1)CH4(g)+2SO2(g)
 2S(s)+CO2(g)+2H2O(g) △H=
2S(s)+CO2(g)+2H2O(g) △H=(2)某温度下,向容积为2L的密闭容器中充入1.0molCH4和2.0molSO2,发生反应CH4(g)+2SO2(g)
 2S (s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
2S (s)+CO2(g)+2H2O(g),CH4、CO2、SO2的物质的量随反应时间的变化情况如图所示。
①反应开始至达到平衡时,平均反应速率v(H2O)=
②5min时,改变的外界条件可能是
A.升高温度 B.降低温度 C.加入催化剂 D.充入CH4(g)
(3)一定温度下,向某密容器中充入一定量的CH4和SO2发生反应CH4(g)+2SO2(g)
 2S(s)+CO2(g)+2H2O(g)。
2S(s)+CO2(g)+2H2O(g)。①若该容器容积恒定,则下列物理量不再改变时,一定能说明反应达到平衡状态的是
A.m(S) B.

C.CH4和CO2的浓度之和 D.容器中气体的密度
②该温度下,欲提高SO2的平衡转化率,可采取的措施有
更新时间:2022-12-22 08:41:08
|
【知识点】 化学反应原理综合考查解读
相似题推荐
解答题-原理综合题
|
较难
(0.4)
解题方法
【推荐1】乙(基)苯是制苯乙烯的原料,苯乙烯是制聚苯乙烯、丁苯橡胶的原料。工业生产乙苯主要有两种方法:一、石油催化重整;二、苯和乙烯合成乙苯。
已知:在标准压强(100KPa)、一定温度下,由最稳定的单质合成1mol物质B的反应焓变,叫做物质B的标准摩尔生成焓,用 表示,单位:kJ·mol-1。下表是一些物质的标准摩尔生成焓:
表示,单位:kJ·mol-1。下表是一些物质的标准摩尔生成焓:
请回答:
(1)写出苯和乙烯合成乙苯的热化学方程式_______ ;判断该反应的自发性并说明理由_______ 。
(2)石油催化重整中存在C8H10异构体相互转化,画出乙苯→邻二甲苯→间二甲苯→对二甲苯相互转化的能量-反应过程示意图_______ 。

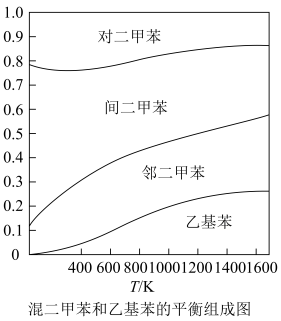
(3)石油催化重整过程中,几种异构体之间存在转化平衡,温度和平衡组分关系如图所示。结合数据分析,温度升高,乙苯和邻二甲苯含量均增加原因_______ 。
(4)有关石油化工中制备乙苯的方法,下列说法正确的是_______。
(5)工业上常采用乙苯氧化法制苯乙烯,相应的化学方程式为
Ⅰ、
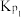 =2.7x10-15,△HⅠ=23.47kJ·mol-1
=2.7x10-15,△HⅠ=23.47kJ·mol-1
Ⅱ、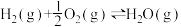
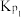 =1.26×1040,△HⅡ=-241.82 kJ·mol-1
=1.26×1040,△HⅡ=-241.82 kJ·mol-1
结合数据说明乙苯制苯乙烯过程中加氧气的理由_______ 。
已知:在标准压强(100KPa)、一定温度下,由最稳定的单质合成1mol物质B的反应焓变,叫做物质B的标准摩尔生成焓,用
 表示,单位:kJ·mol-1。下表是一些物质的标准摩尔生成焓:
表示,单位:kJ·mol-1。下表是一些物质的标准摩尔生成焓:| 物质 |  | 物质 |  | 物质 |  | 物质 |  |
| H2(g) | 0 | 乙苯(g) | 29.79 | 乙烯(g) | 52.26 | 苯(g) | 82.93 |
| C(s) | 0 | 邻二甲苯(g) | 19 | 间二甲苯(g) | 17.24 | 对二甲苯(g) | 17.95 |
请回答:
(1)写出苯和乙烯合成乙苯的热化学方程式
(2)石油催化重整中存在C8H10异构体相互转化,画出乙苯→邻二甲苯→间二甲苯→对二甲苯相互转化的能量-反应过程示意图

(3)石油催化重整过程中,几种异构体之间存在转化平衡,温度和平衡组分关系如图所示。结合数据分析,温度升高,乙苯和邻二甲苯含量均增加原因

(4)有关石油化工中制备乙苯的方法,下列说法正确的是_______。
| A.苯和乙烯合成乙苯时,用分子筛固体酸代替无水氯化铝作催化剂能大幅降低对环境的污染 |
| B.苯和乙烯合成乙苯时,采用高温高压条件有利于提高平衡转化率 |
| C.石油催化重整过程中,采用高压条件可以提高C8H10异构体中乙苯的含量 |
| D.石油催化重整过程中,不断分离乙苯,可以提高乙苯产率 |
Ⅰ、

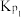 =2.7x10-15,△HⅠ=23.47kJ·mol-1
=2.7x10-15,△HⅠ=23.47kJ·mol-1Ⅱ、
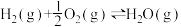
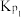 =1.26×1040,△HⅡ=-241.82 kJ·mol-1
=1.26×1040,△HⅡ=-241.82 kJ·mol-1结合数据说明乙苯制苯乙烯过程中加氧气的理由
您最近一年使用:0次
解答题-原理综合题
|
较难
(0.4)
名校
解题方法
【推荐2】以天然气代替石油生产液体燃料和基础化学品是当前化学研究和发展的重点。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
写出甲烷一步生成乙烯的热化学方程式_________________________ ,反应中硅化物晶格限域的单中心铁催化剂的作用是________________________ ;
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为___________ ;
③生成1 mol Z产生的H2约合标准状况下________ L。
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系
(其中n(H2O):n(C2H4)=1:1)。
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=____________ (用平衡分压代替平衡浓度计算;分压=总压×物质的量分数;结果保留到小数点后两位);
②该反应为__________ (填“吸热”或“放热”)反应,图中压强(p1、p2、p3、p4)的大小关系为____________ ,理由是________________ ;
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有______________ (任写两条)。
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式________________________________ 。
(1)我国科学家创造性地构建了硅化物晶格限域的单中心铁催化剂,成功实现了甲烷一步高效生产乙烯、芳香烃Y和芳香烃Z等重要化工原料,实现了CO2的零排放,碳原子利用率达100%。已知Y、Z的相对分子质量分别为78、128,其一氯代物分别有1种和2种。
①有关化学键键能数据如表中所示:
化学键 | H-H | C=C | C-C | C≡C | C-H |
E(kJ/mol) | 436 | 615 | 347.7 | 812 | 413.4 |
写出甲烷一步生成乙烯的热化学方程式
②已知:原子利用率=期望产物总质量/反应物总质量×100%,则甲烷生成芳香烃Y的原子利用率为
③生成1 mol Z产生的H2约合标准状况下
(2)如图为乙烯气相直接水合法制备乙醇中乙烯的平衡转化率与温度、压强的关系
(其中n(H2O):n(C2H4)=1:1)。
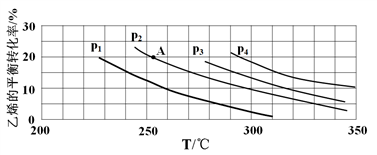
①若p2=8.0 MPa,列式计算A点的平衡常数Kp=
②该反应为
③气相直接水合法常采用的工艺条件:磷酸/硅藻土为催化剂,反应温度为290℃,压强为6.9 MPa,n(H2O):n(C2H4)=0.6:1。乙烯的转化率为5%,若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有
(3)乙烯可以作为燃料电池的负极燃料,请写出以熔融碳酸盐作为电解质时,负极的电极反应式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
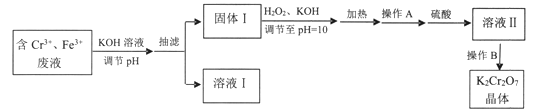
【推荐3】某研究性小组用含铬废水制取具有强氧化性的重铬酸钾(K2Cr2O7),实验方案如下:
已知:
①Cr2O72-(橙色)+H2O 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+
②金属离子沉淀的PH如下:
③不同温度下化合物的溶解度如下:
请回答:
(1)操作A的名称是____ ,加入硫酸的目的是_____ 。
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式________ 。
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是__________ 。
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作__________ 。
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
则测得K2Cr2O7产品的纯度是_________ (以质量分数表示)。
已知:
①Cr2O72-(橙色)+H2O
 2CrO42-(黄色)+2H+
2CrO42-(黄色)+2H+②金属离子沉淀的PH如下:
| 离子 | 开始沉淀的PH | 沉淀完全的PH |
| Cr3+ | 4.9 | 6.8 |
| Fe3+ | 1.5 | 4.1 |
| 物质 | 溶解度/(g/110g水) | ||
| 0℃ | 40℃ | 80℃ | |
| K2SO4 | 7.4 | 14.8 | 21.4 |
| K2Cr2O7 | 4.7 | 26.3 | 73 |
(1)操作A的名称是
(2)写出固体1中加入H2O2和KOH溶液后发生反应的离子方程式
(3)操作B由多步组成,获得K2Cr2O7晶体的操作依次是:蒸发浓缩、操作1、洗涤1、操作2、抽滤、洗涤2、干燥。则下列说法正确的是
A.操作1和操作2分别是趁热过滤和冷却结晶
B.洗涤1和洗涤2所用的洗涤剂分别为0℃的冷水和80℃的热水
C.当溶液出现过饱和现象时,振荡容器或用玻璃棒轻轻摩擦器壁均可促使晶体析出
D.进行洗涤2操作时,可用摩尔盐[(NH4)2SO4·FeSO4·6H2O]标准溶液滴定,反应的离子方程式:
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
①请简述将已用移液管吸取的待测液转移至锥形瓶中的操作
②滴定时,先称取0.5000g K2Cr2O7 产品,溶于水配成100mL溶液,用0.1000mol/L的摩尔盐标准溶液进行滴定,数据记录如下:
| 实验序号 | 待测样品溶液的体积/mL | 0.1000mol/L摩尔盐溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 24.98 |
| 2 | 25.00 | 1.56 | 29.30 |
| 3 | 25.00 | 1.00 | 26.02 |
您最近一年使用:0次



