盐酸和氢氧化钠是工业上重要的化工原料,也是实验室里常见的试剂。
I.欲使用0.30mol/L的 溶液950mL,现拟用36.5%(
溶液950mL,现拟用36.5%(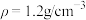 )的浓盐酸来配制,请回答下列问题:
)的浓盐酸来配制,请回答下列问题:
(1)配制溶液所用36.5%的盐酸的体积为_______ 。
(2)该实验需要使用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、_______ 。
(3)下列操作会使所配溶液浓度小于0.30mol/L的是:_______ 。(填对应的序号)
a、容量瓶用蒸馏水洗净后没有烘干,瓶内有少量残留的蒸馏水;
b、在操作中没有用蒸馏水洗涤烧杯和玻璃棒;
c、定容时视线俯视刻度线;
d、定容时加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水定容到刻度线;
e、将配制好的溶液转入试剂瓶的过程中不慎洒出了少许溶液;
f、用量筒量取浓盐酸时视线仰视刻度线。
II.酸碱中和滴定
(4)某学生用盐酸标准液测定氢氧化钠待测液时,选择酚酞作指示剂。达到滴定终点的现象是_______ 。滴定时不必用到的仪器是_______ 。
A.酸式滴定管 B.容量瓶 C.锥形瓶 D.铁架台
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,此时消耗盐酸的体积为_______ mL。已知用 的盐酸标定25mL的氢氧化钠溶液,则测得
的盐酸标定25mL的氢氧化钠溶液,则测得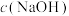 为
为_______  。
。
III.为了测定摩尔盐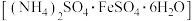 产品的纯度,称取ag样品溶于水,配制成500mL溶液,用浓度为
产品的纯度,称取ag样品溶于水,配制成500mL溶液,用浓度为 的酸性
的酸性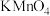 溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
(6)滴定过程中发生反应的离子方程式为_______ 。
(7)通过实验数据计算该产品的纯度:_______ (用含字母a、c的式子表示,用M表示摩尔盐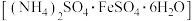 的摩尔质量)。上表第一次实验中记录的数据明显大于后两次,其原因可能是
的摩尔质量)。上表第一次实验中记录的数据明显大于后两次,其原因可能是_______ 。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
I.欲使用0.30mol/L的
 溶液950mL,现拟用36.5%(
溶液950mL,现拟用36.5%(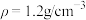 )的浓盐酸来配制,请回答下列问题:
)的浓盐酸来配制,请回答下列问题:(1)配制溶液所用36.5%的盐酸的体积为
(2)该实验需要使用到的玻璃仪器有:烧杯、玻璃棒、胶头滴管、
(3)下列操作会使所配溶液浓度小于0.30mol/L的是:
a、容量瓶用蒸馏水洗净后没有烘干,瓶内有少量残留的蒸馏水;
b、在操作中没有用蒸馏水洗涤烧杯和玻璃棒;
c、定容时视线俯视刻度线;
d、定容时加蒸馏水超过了刻度线,倒出一些溶液,再重新加蒸馏水定容到刻度线;
e、将配制好的溶液转入试剂瓶的过程中不慎洒出了少许溶液;
f、用量筒量取浓盐酸时视线仰视刻度线。
II.酸碱中和滴定
(4)某学生用盐酸标准液测定氢氧化钠待测液时,选择酚酞作指示剂。达到滴定终点的现象是
A.酸式滴定管 B.容量瓶 C.锥形瓶 D.铁架台
(5)若滴定开始和结束时,酸式滴定管中的液面如图所示,此时消耗盐酸的体积为
 的盐酸标定25mL的氢氧化钠溶液,则测得
的盐酸标定25mL的氢氧化钠溶液,则测得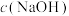 为
为 。
。
III.为了测定摩尔盐
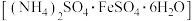 产品的纯度,称取ag样品溶于水,配制成500mL溶液,用浓度为
产品的纯度,称取ag样品溶于水,配制成500mL溶液,用浓度为 的酸性
的酸性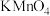 溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
(7)通过实验数据计算该产品的纯度:
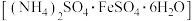 的摩尔质量)。上表第一次实验中记录的数据明显大于后两次,其原因可能是
的摩尔质量)。上表第一次实验中记录的数据明显大于后两次,其原因可能是A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
更新时间:2023-01-10 09:44:10
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐1】传统的定量化学实验受到计量手段的制约而研究范围狭窄、精确度不高,DIS数字化信息系统(由传感器、数据采集器和计算机组成)因为可以准确测量溶液的pH等而在中和滴定的研究中应用越来越广泛深入。
(1)某学习小组利用 DIS 系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000 mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000 mol/L的NaOH溶液分别滴定10.00 mL 0.1000 mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
③由计算机绘制的滴定曲线如图:
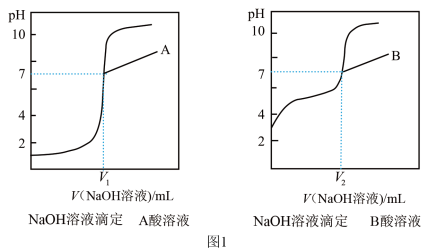
(2)①A是_____ 酸(填“醋酸”或“盐酸”)
②两曲线图中 V1________ V2(填“>”“=”或“<”),A点和B点,水的电离程度_____ (填“A 点大”、“B 点大”、“A 和 B 点相同”或“无法判断”)
(3)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用________ (填仪器名称)量取 20.00 mL 醋酸溶液样品,倒入洁净干燥锥形瓶中,连接好 DIS系统,如果锥形瓶中含有少量蒸馏水,是否会影响测量结果?______ (填“是”“否”或“不能确定”)。向锥形瓶中滴加 0.1000 mol/L的NaOH溶液,计算机屏幕上显示溶液导电能力与加入NaOH溶液体积关系的曲线图(见如图)。
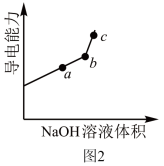
②醋酸与NaOH溶液反应的离子方程式为______ 。
③图中b点时,溶液中各离子浓度大小的关系是_________ ,c(CH3COOH)+c(CH3COO-)=_________ mol/L。
④若图中某一点 pH 等于8,则 c(Na+)-c(CH3COO-)的精确值为________ mol/L。
(1)某学习小组利用 DIS 系统探究强碱和不同酸的中和反应,实验过程如下:
①分别配制0.1000 mol/L的NaOH、HCl、CH3COOH溶液备用。
②用0.1000 mol/L的NaOH溶液分别滴定10.00 mL 0.1000 mol/L的HCl和CH3COOH溶液,连接数据采集器和pH传感器。
③由计算机绘制的滴定曲线如图:

(2)①A是
②两曲线图中 V1
(3)另一个学习小组利用DIS系统测定某醋酸溶液的物质的量浓度,以测量溶液导电能力来判断滴定终点,实验步骤如下:
①用

②醋酸与NaOH溶液反应的离子方程式为
③图中b点时,溶液中各离子浓度大小的关系是
④若图中某一点 pH 等于8,则 c(Na+)-c(CH3COO-)的精确值为
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
【推荐2】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑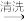
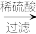 溶液A
溶液A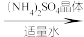

 莫尔盐
莫尔盐
(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是__ 。
(2)浓度均为0.10 mol·L-1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者_______ 后者。(填“大于”、“小于”、“等于”或“无法判断”)
(3)0.10 mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为_______ 。
(4)常温下,(NH4)2SO4溶液呈酸性的原因_______ (用离子方程式表示)。
(5)用标准浓度的莫尔盐溶液定量分析某样品中KMnO4的含量。
①称量1.5800 g KMnO4样品于烧杯中,溶解后加稀H2SO4酸化,配成250 mL溶液。
②取0.1000 mol·L-1的莫尔盐标准溶液25.00mL于锥形瓶中,然后用KMnO4样品溶液滴定。滴定终点的现象是_______ 。平行滴定3次,样品溶液的平均用量为17.50 mL,则样品纯度为_______ 。(保留三位有效数字)
废铁屑
 溶液A
溶液A

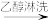 莫尔盐
莫尔盐(1)向废铁屑中加入稀硫酸后,不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是
(2)浓度均为0.10 mol·L-1的莫尔盐溶液和FeSO4溶液,c(Fe2+)前者
(3)0.10 mol·L-1莫尔盐溶液中离子浓度由大到小的顺序为
(4)常温下,(NH4)2SO4溶液呈酸性的原因
(5)用标准浓度的莫尔盐溶液定量分析某样品中KMnO4的含量。
①称量1.5800 g KMnO4样品于烧杯中,溶解后加稀H2SO4酸化,配成250 mL溶液。
②取0.1000 mol·L-1的莫尔盐标准溶液25.00mL于锥形瓶中,然后用KMnO4样品溶液滴定。滴定终点的现象是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】磷的氯化物常见的有二种:①三氯化磷(PCl3) ,为无色澄清液体,在潮湿空气中发烟,有毒,熔点-111.8 ℃, 沸点76 ℃;②五氯化磷(PCl5)易升华。某兴趣小组拟通过下列装置,在实验室中制备PCl3。

(1)C装置中玻璃仪器的名称是___________ 。
(2)写出A中反应的离子方程式:___________ 。
(3)制备PCl3装置的合理排列顺序为:___________ 。 该装置在制备过程中可能存在的安全隐患是___________ 。
(4)测定粗产品中三氯化磷的含量的原理:三氯化磷与水反应生成亚磷酸,用定量过量的碘单质将亚磷酸氧化成正磷酸,用硼酸铵中和该反应生成的酸,剩余的碘单质用硫代硫酸钠标准溶液滴定,以淀粉为指示剂判定终点。
①滴定终点的现象:___________ 。
②以下说法不正确的是___________ 。
A.用蒸馏水洗涤酸式滴定管后,再用硫代硫酸钠标准液润洗
B.滴定过程中眼睛注视滴定管中液面变化情况
C.滴定过程中,锥形瓶振荡得幅度较大,有利于充分反应,滴定结果准确
D.滴定前平视刻度线,滴定后仰视,测定的结果偏低

(1)C装置中玻璃仪器的名称是
(2)写出A中反应的离子方程式:
(3)制备PCl3装置的合理排列顺序为:
(4)测定粗产品中三氯化磷的含量的原理:三氯化磷与水反应生成亚磷酸,用定量过量的碘单质将亚磷酸氧化成正磷酸,用硼酸铵中和该反应生成的酸,剩余的碘单质用硫代硫酸钠标准溶液滴定,以淀粉为指示剂判定终点。
①滴定终点的现象:
②以下说法不正确的是
A.用蒸馏水洗涤酸式滴定管后,再用硫代硫酸钠标准液润洗
B.滴定过程中眼睛注视滴定管中液面变化情况
C.滴定过程中,锥形瓶振荡得幅度较大,有利于充分反应,滴定结果准确
D.滴定前平视刻度线,滴定后仰视,测定的结果偏低
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐1】实验室需配制480mL0.1mol/L的碳酸钠溶液,填空并回答下列问题:
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
(2)配制时,其正确的操作顺序为(用字母表示,每个字母只能用一次)____________
A.将容量瓶盖紧,上下颠倒,摇匀
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
F.改为胶头滴管加水,使溶液凹液面恰好与刻度线相切
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若容量瓶中有少量蒸馏水,结果会______ ;
若定容时俯视刻度线,结果会________ 。
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度_________________ 。
(1)配制480mL 0.1 mol/L的Na2CO3溶液。
| 实际应称Na2CO3质量/g | 应选用容量瓶的规格/mL |
| | |
A.将容量瓶盖紧,上下颠倒,摇匀
B.将准确称量的Na2CO3固体倒入烧杯中,再加适量水溶解
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.用30 mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
E.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
F.改为胶头滴管加水,使溶液凹液面恰好与刻度线相切
(3)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”“偏低”或“无影响”)
若容量瓶中有少量蒸馏水,结果会
若定容时俯视刻度线,结果会
(4)若实验过程中出现如下情况如何处理?
加蒸馏水时不慎超过了刻度
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:

(1)该浓盐酸中HCl的物质的量浓度为________ mol/L。
(2)某学生欲用上述浓盐酸和蒸馏水配制450 mL物质的量浓度为0.1 mol/L稀盐酸:
①该学生需要量取________ mL上述浓盐酸进行配制。
②配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是_____ 、______ (填写名称)
③配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)_______ ;
A.用30mL蒸馏水洗涤烧杯及玻璃棒2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1—2cm处
④在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是________
A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶

(1)该浓盐酸中HCl的物质的量浓度为
(2)某学生欲用上述浓盐酸和蒸馏水配制450 mL物质的量浓度为0.1 mol/L稀盐酸:
①该学生需要量取
②配制过程中,除需要使用烧杯、量筒、玻璃棒外,还需要使用的仪器是
③配制时,其正确的操作顺序是(要求用字母表示,每个字母只能用一次)
A.用30mL蒸馏水洗涤烧杯及玻璃棒2—3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量蒸馏水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加蒸馏水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加蒸馏水,直到液面接近刻线1—2cm处
④在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏高的是
A.摇匀后静置,发现液面低于刻线,继续加水至与刻线相切
B.溶液注入容量瓶前没有恢复到室温就进行定容
C.定容时仰视刻线
D.在配制前用已知浓度的稀盐酸润洗容量瓶
您最近一年使用:0次





