实验时需用约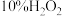 溶液
溶液 ,现用市售
,现用市售 (密度近似为
(密度近似为 )的
)的 来配制,简述其具体配制方法
来配制,简述其具体配制方法_______ 。
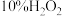 溶液
溶液 ,现用市售
,现用市售 (密度近似为
(密度近似为 )的
)的 来配制,简述其具体配制方法
来配制,简述其具体配制方法
更新时间:2023-02-08 09:00:30
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】溶液的浓度在生产生活中用途广泛,请填空
(1)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c( )=
)=______ 。
(2)某溶液中含有离子: 、
、 、
、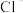 、
、 ,测得
,测得 、
、 和
和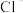 的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c(
的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c( )=
)=______ .
(3)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为___ 。
(4)VmLAl2(SO4)3溶液中含 ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中
ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中 的物质的量浓度是
的物质的量浓度是______ mol/L。
(1)100mL硫酸钠溶液中n(Na+)=0.2mol,则其中c(
 )=
)=(2)某溶液中含有离子:
 、
、 、
、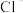 、
、 ,测得
,测得 、
、 和
和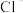 的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c(
的物质的量浓度依次为:0.2mol∙L﹣1、0.25mol∙L﹣1、0.4mol∙L﹣1,则c( )=
)=(3)有等体积的NaCl、CaCl2、AlCl3三种溶液,分别与足量的AgNO3溶液反应,若生成沉淀的质量相等,则三种溶液中所含溶质的物质的量浓度之比为
(4)VmLAl2(SO4)3溶液中含
 ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中
ag,取0.5VmL溶液稀释到2VmL,则稀释后溶液中 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】硫有多种含氧酸,亚硫酸(H2SO3)、硫酸(H2SO4)、焦硫酸(H2SO4·SO3)……等,其中硫酸最为重要,在工业上有广泛的应用。试回答以下问题(并写出必要的过程):
(1)已知某硫酸溶液的的密度为1.84g/cm3,质量分数为98%,该硫酸溶液的物质的量浓度为____ mol·L-1。
(2)若将其稀释为500mL0.2mol/L的溶液,需用量筒取该浓硫酸___ mL。
(3)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将89g焦硫酸溶于水配成800mL硫酸,则该硫酸的物质的量浓度为____ mol·L-1。(提示:SO3+H2O=H2SO4)
(4)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:4FeS2+11O2=2Fe2O3+8SO2,若参加反应的FeS2为2.4mol,则生成的SO2的体积为___ L(标准状况)。
(1)已知某硫酸溶液的的密度为1.84g/cm3,质量分数为98%,该硫酸溶液的物质的量浓度为
(2)若将其稀释为500mL0.2mol/L的溶液,需用量筒取该浓硫酸
(3)焦硫酸(H2SO4·SO3)溶于水,其中的SO3都转化为硫酸。若将89g焦硫酸溶于水配成800mL硫酸,则该硫酸的物质的量浓度为
(4)硫铁矿是工业上制硫酸的主要原料。硫铁矿氧化焙烧的化学反应如下:4FeS2+11O2=2Fe2O3+8SO2,若参加反应的FeS2为2.4mol,则生成的SO2的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】(1)3.6gH2O的物质的量是_______ mol,含有_________ 个H2O,含有_____ molH,含_____ mol电子。
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是_________ ,相对分子质量为________ ;等物质的量的NH3与H2S质量比为___________ ,1.7g氨气与________ mol H2O含有的电子数相等。
(3)将1.06g Na2CO3溶于水配成500mL溶液,Na2CO3的浓度为______ mol/L,Na+浓度为______ mol/L,将该溶液加水稀释成1000 mL后,Na+浓度为____ mol/L。
(2)标准状况下,11.2L的H2R气体质量为17g,则H2R的摩尔质量是
(3)将1.06g Na2CO3溶于水配成500mL溶液,Na2CO3的浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】根据所学知识,按要求填写下列空格。
(1)约含 个氧原子的
个氧原子的 的物质的量为
的物质的量为___________  ,与上述
,与上述 中所含原子总数相同的
中所含原子总数相同的 标准状况下体积是
标准状况下体积是___________ L;
(2) 硫酸铝溶液中,
硫酸铝溶液中,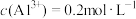 ,则
,则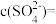
___________  ;将该溶液稀释至
;将该溶液稀释至 ,稀释后溶液中的
,稀释后溶液中的 的物质的量为
的物质的量为___________  。
。
(3) 某金属硝酸盐
某金属硝酸盐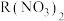 中含有
中含有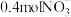 ,则
,则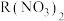 的摩尔质量为
的摩尔质量为___________ , 的相对原子质量为
的相对原子质量为___________ 。
(4)现有标准状况下 和
和 混合气体为
混合气体为 ,其质量为
,其质量为 ,则此混合气体中,
,则此混合气体中, 和
和 的物质的量之比为
的物质的量之比为___________ ,C和O原子个数比为___________ 。
(1)约含
 个氧原子的
个氧原子的 的物质的量为
的物质的量为 ,与上述
,与上述 中所含原子总数相同的
中所含原子总数相同的 标准状况下体积是
标准状况下体积是(2)
 硫酸铝溶液中,
硫酸铝溶液中,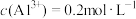 ,则
,则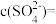
 ;将该溶液稀释至
;将该溶液稀释至 ,稀释后溶液中的
,稀释后溶液中的 的物质的量为
的物质的量为 。
。(3)
 某金属硝酸盐
某金属硝酸盐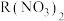 中含有
中含有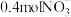 ,则
,则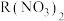 的摩尔质量为
的摩尔质量为 的相对原子质量为
的相对原子质量为(4)现有标准状况下
 和
和 混合气体为
混合气体为 ,其质量为
,其质量为 ,则此混合气体中,
,则此混合气体中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】在加热条件下,用MnO2与足量浓盐酸反应,制得氯气1.12L(标况下),已知反应后溶液体积为50mL。试计算:
(1)写出该反应的化学方程式_______ ;
(2)理论上需要消耗MnO2的质量为_______ ;
(3)若将上述反应后的溶液稀释至250mL,则稀释后的溶液中MnCl2的物质的量浓度为_____ 。
(1)写出该反应的化学方程式
(2)理论上需要消耗MnO2的质量为
(3)若将上述反应后的溶液稀释至250mL,则稀释后的溶液中MnCl2的物质的量浓度为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】下图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容。
现用该浓硫酸配制480mL1mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有___________ (写仪器名称);
(2)经计算,配制上述的稀硫酸需要用量筒量取上述浓硫酸的体积为___________ mL,量取硫酸时应选用___________ 规格的量筒;
A.10mLB.50mLC.100mLD.200mL
(3)在烧杯中稀释浓硫酸的实验操作为___________ 。若在稀释过程中,少量浓硫酸不慎沾在手上,处理方法为___________ 。
(4)对所配制的稀硫酸进行测定,发现其浓度大于1mol·L-1,配制过程中下列各项操作可能引起该误差的原因___________ 。
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
| 硫酸 化学纯(CP)(500mL) 品名:硫酸 化学式:H2SO4 相对分子质量:98 密度:1.84g·cm-3 质量分数:98% |
现用该浓硫酸配制480mL1mol·L-1的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。
请回答下列问题:
(1)配制稀硫酸时,还缺少的仪器有
(2)经计算,配制上述的稀硫酸需要用量筒量取上述浓硫酸的体积为
A.10mLB.50mLC.100mLD.200mL
(3)在烧杯中稀释浓硫酸的实验操作为
(4)对所配制的稀硫酸进行测定,发现其浓度大于1mol·L-1,配制过程中下列各项操作可能引起该误差的原因
①用量筒量取浓硫酸时,仰视刻度线
②容量瓶用蒸馏水洗涤后未经干燥
③将稀释后的稀硫酸立即转入容量瓶后,立即进行后面的实验操作
④转移溶液时,不慎有少量溶液洒出
⑤定容时,俯视容量瓶刻度线
⑥定容后,把容量瓶倒置摇匀,正放后发现液面低于刻度线,又补充几滴水至刻度处
您最近一年使用:0次



