已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①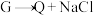
②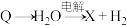
③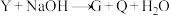
④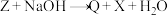
这五种化合物中 元素化合价由低到高的顺序是
元素化合价由低到高的顺序是_______ 。
①
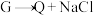
②
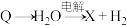
③
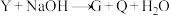
④
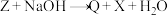
这五种化合物中
 元素化合价由低到高的顺序是
元素化合价由低到高的顺序是
更新时间:2023-03-08 18:29:14
|
相似题推荐
【推荐1】实验室可用KMnO4和浓盐酸反应制取氯气,反应原理:2KMnO4+16HCl(浓)= 2KCl+2MnCl2+ 5Cl2↑+ 8H2O。
(1)用双线桥标出电子得失情况:___________ 。
(2)由此反应可以推断氧化性强弱KMnO4___________ Cl2(填“>”、“<”或“=”)。
(3)浓盐酸在反应中显示出来的性质是___________ (填序号)。
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若参加反应的HCl是73g,则被氧化的HCl有___________ g(保留一位小数点)。
(5)某同学设计如下实验探究H2O2的性质:
①从理论上看H2O2既有氧化性又有还原性,具有还原性的原因是___________ 。
②能证明H2O2具有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ 。
(6)将反应配平:____________________ 。
______OH-+______ClO-+______Fe3+=_______ +_____Cl-+______H2O
+_____Cl-+______H2O
(1)用双线桥标出电子得失情况:
(2)由此反应可以推断氧化性强弱KMnO4
(3)浓盐酸在反应中显示出来的性质是
①只有还原性 ②还原性和酸性 ③只有氧化性 ④氧化性和酸性
(4)若参加反应的HCl是73g,则被氧化的HCl有
(5)某同学设计如下实验探究H2O2的性质:
| 序号 | 实验 | 实验现象 |
| ⅰ | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去;b.有大量气泡产生 |
| ⅱ | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
②能证明H2O2具有还原性的实验是
(6)将反应配平:
______OH-+______ClO-+______Fe3+=_______
 +_____Cl-+______H2O
+_____Cl-+______H2O
您最近半年使用:0次
填空题
|
适中
(0.65)
【推荐2】高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O3、ClO2、KMnO4氧化性更强,无二次污染。工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的还原剂是_______ ,该反应每生成1 mol Na2FeO4转移_____ mol电子。
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用:一是K2FeO4氧化性强,可以消毒杀菌;二是__________________ 。
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO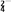 、Cl-、H2O。
、Cl-、H2O。
①写出并配平湿法制备高铁酸钾的离子反应方程式:_____________________ 。
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为________ 。
③低温下,向高铁酸钠溶液中加入KOH至饱和,可析出高铁酸钾(K2FeO4),说明了什么问题______________________ 。
(1)干法制备高铁酸钾的主要反应为:2FeSO4+6Na2O2===2Na2FeO4+2Na2O+2Na2SO4+O2↑。
①该反应中的还原剂是
②简要说明K2FeO4作为水处理剂时,在水处理过程中所起的作用:一是K2FeO4氧化性强,可以消毒杀菌;二是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO
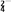 、Cl-、H2O。
、Cl-、H2O。①写出并配平湿法制备高铁酸钾的离子反应方程式:
②若反应过程中转移了0.3 mol电子,则还原产物的物质的量为
③低温下,向高铁酸钠溶液中加入KOH至饱和,可析出高铁酸钾(K2FeO4),说明了什么问题
您最近半年使用:0次

 的形式存在。已知在溶液中
的形式存在。已知在溶液中 与
与 可发生反应:
可发生反应: ,根据上述反应,可用试纸和一些常见试剂进行实验,证明食盐中存在
,根据上述反应,可用试纸和一些常见试剂进行实验,证明食盐中存在 )⑦乙醇
)⑦乙醇

