在某密闭容器中,一定条件下,对于反应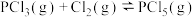
 ,下列说法错误的是
,下列说法错误的是
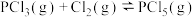
 ,下列说法错误的是
,下列说法错误的是| A.该反应为可逆反应 |
| B.升高温度,正反应速率增大 |
C.该反应达到平衡状态时, |
| D.该反应的反应物的键能总和小于生成物的键能总和 |
更新时间:2023-04-18 21:57:09
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】氢气在氯气中燃烧产生苍白色火焰,气态氯化氢。已知破坏1 mol H—H键消耗的能量为Q1 kJ,破坏1 mol Cl—Cl键消耗的能量为Q2 kJ,形成1 mol H—Cl键释放的能量为Q3 kJ。下列关系式中正确的是( )
| A.2Q1+Q2>4Q3 | B.2Q1+Q2<4Q3 |
| C.Q1+Q2<Q3 | D.Q1+Q2<2Q3 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐2】下列反应中,反应物的总键能大于生成物的总键能的是
A. 与水反应 与水反应 | B. 与 与 反应 反应 |
| C.甲烷的燃烧 | D.稀硫酸与 溶液的反应 溶液的反应 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐3】下列关于热化学方程式说法正确的是
A.450℃、15MPa下,将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放出19.3kJ热量,由此推断其热化学方程式为: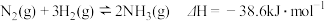 |
B.已知: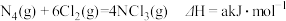 , ,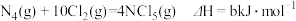 , N4具有正四面体结构,NCl5中N—Cl键的键能为ckJ·mol-1,NCl3中N—Cl键的键能为1.2ckJ·mol-1,由此计算Cl—Cl键的键能(b-a+5.6c)/4kJ·mol-1 , N4具有正四面体结构,NCl5中N—Cl键的键能为ckJ·mol-1,NCl3中N—Cl键的键能为1.2ckJ·mol-1,由此计算Cl—Cl键的键能(b-a+5.6c)/4kJ·mol-1 |
C.已知 ,则金刚石比石墨稳定 ,则金刚石比石墨稳定 |
D.已知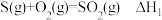 ; ;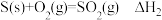 ,则ΔH1>ΔH2 ,则ΔH1>ΔH2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】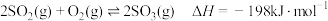 ,在V2O5存在时,该反应的机理为
,在V2O5存在时,该反应的机理为 (快)、
(快)、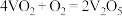 (慢)。下列说法正确的是
(慢)。下列说法正确的是
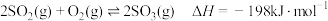 ,在V2O5存在时,该反应的机理为
,在V2O5存在时,该反应的机理为 (快)、
(快)、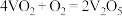 (慢)。下列说法正确的是
(慢)。下列说法正确的是| A.反应速率主要取决于V2O5的质量 |
| B.V2O5是反应的中间产物 |
C.逆反应的活化能大于198 |
| D.升高温度,正反应速率减慢,逆反应速率加快 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】一定条件下,恒容密闭容器中发生反应: ,下列说法中错误的是
,下列说法中错误的是
 ,下列说法中错误的是
,下列说法中错误的是A. 不可能100%转化为 不可能100%转化为 | B.升高温度可加快反应速率 |
| C.平衡时,两种气体的浓度保持不变 | D.平衡时,正、逆反应速率均为0 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】设 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.7.8g 和 和 混合物中所含的阴离子总数为0.1 混合物中所含的阴离子总数为0.1 |
B.1L0.1mol/L 溶液中 溶液中 离子数为0.1 离子数为0.1 |
C.常温常压下,124g 中所含P-P键的数目为4 中所含P-P键的数目为4 |
D.向密闭容器中充入1mol 与1mol 与1mol 充分反应后容器内的分子数小于2 充分反应后容器内的分子数小于2 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】对于可逆反应M + 3N 2Q达到平衡时,下列说法正确的是
2Q达到平衡时,下列说法正确的是
 2Q达到平衡时,下列说法正确的是
2Q达到平衡时,下列说法正确的是| A.反应已经停止 |
| B.M、N全部变成了Q |
| C.反应混合物各组分的浓度不再变化 |
| D.M、N、Q三种物质的浓度一定相等 |
您最近一年使用:0次

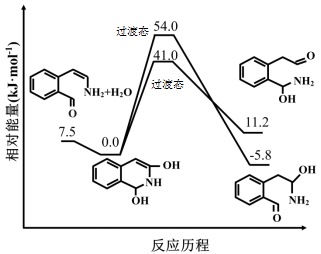
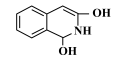 比
比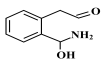 稳定
稳定 的反应速率增大幅度大于生成
的反应速率增大幅度大于生成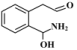 的反应速率
的反应速率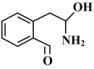 的比例
的比例 2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是
2NH3(g) △H=-92kJ·mol-1下列关于此反应的说法中错误的是

