研究化学反应中的能量变化具有重要意义:
Ⅰ.写出下列反应的热化学方程式
(1)1mol (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出1299.6kJ的热量
和液态水,放出1299.6kJ的热量___________ 。
(2)23g (l)在
(l)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出683.4kJ的热量
和液态水,放出683.4kJ的热量________ 。
Ⅱ.50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:

(3)从实验装置上看,图中尚缺少的一种玻璃仪器是___________ 。
(4)隔热层的作用是___________ 。
(5)倒入NaOH溶液的正确操作是___________ (填字母)。
a.沿玻璃棒缓慢倒入 b.分三次少量倒入 c.一次迅速倒入
Ⅲ.学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(6)键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
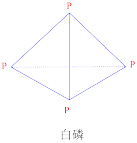
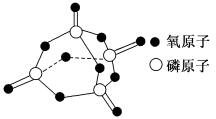
已知白磷的燃烧热为2378.0kJ/mol,白磷(白磷的结构如图)完全燃烧的产物结构如图所示,则上表中X=___________ 。
(7)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为___________ kJ/mol(用x、y表示)。
Ⅰ.写出下列反应的热化学方程式
(1)1mol
 (g)在
(g)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出1299.6kJ的热量
和液态水,放出1299.6kJ的热量(2)23g
 (l)在
(l)在 中完全燃烧生成
中完全燃烧生成 和液态水,放出683.4kJ的热量
和液态水,放出683.4kJ的热量Ⅱ.50 mL 0.50 mol·L-1的盐酸与50 mL 0.55 mol·L-1的NaOH溶液在如图所示的装置中进行中和反应。通过测定反应过程中所放出的热量可计算中和反应反应热。回答下列问题:

(3)从实验装置上看,图中尚缺少的一种玻璃仪器是
(4)隔热层的作用是
(5)倒入NaOH溶液的正确操作是
a.沿玻璃棒缓慢倒入 b.分三次少量倒入 c.一次迅速倒入
Ⅲ.学反应中的能量变化,是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同所致。
(6)键能也可以用于估算化学反应的反应热(ΔH),下表是部分化学键的键能数据:
| 化学键 | P-P | P-O | O=O | P=O |
| 键能/(kJ·mol-1) | 172 | 335 | 498 | X |


(7)1840年,俄国化学家盖斯在分析了许多化学反应热效应的基础上,总结出一条规律:“一个化学反应,不论是一步完成,还是分几步完成,其总的热效应是完全相同的。”这个规律被称为盖斯定律。有些反应的反应热虽然无法直接测得,但可以利用盖斯定律间接计算求得。
已知3.6g碳在6.4g的氧气中燃烧,至反应物耗尽,放出xkJ热量。已知单质碳的燃烧热为ykJ/mol,则1molC与O2反应生成CO的反应热△H为
更新时间:2023-06-05 13:44:00
|
相似题推荐
解答题-实验探究题
|
容易
(0.94)
名校
解题方法
【推荐1】某化学实验小组设计了如图三套实验装置探究化学能与热能的转化关系(装置中夹持仪器已略去)。回答下列问题:
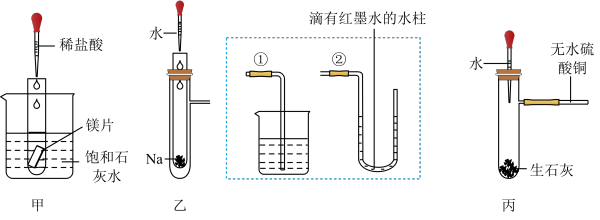
(1)观察到甲装置中的实验现象是____ ;产生该现象的原因是____ 。
(2)将乙装置中外层具支试管的支管与虚线框内的①连接,实验现象是____ ;支管与②连接,实验现象是____ 。钠与水的总能量____ (填“大于”或“小于”)生成物的能量。
(3)装置丙中将胶头滴管内的水滴到生石灰上,支管处的白色粉末(无水硫酸铜)变为蓝色,其原因_____ 。
(4)上述三个实验方案均验证了以上三个反应的反应物化学键断裂吸收的能量____ (填“高于”或“低于”)生成物化学键形成放出的能量;物质中的化学能通过____ 转化成____ 释放出来。

(1)观察到甲装置中的实验现象是
(2)将乙装置中外层具支试管的支管与虚线框内的①连接,实验现象是
(3)装置丙中将胶头滴管内的水滴到生石灰上,支管处的白色粉末(无水硫酸铜)变为蓝色,其原因
(4)上述三个实验方案均验证了以上三个反应的反应物化学键断裂吸收的能量
您最近一年使用:0次
【推荐2】化学反应速率、限度及能量与生产、生活密切相关。
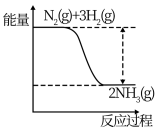
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量___ (填“大于”或“小于”)生成物化学键形成放出的总能量。
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率___ 。(设溶液体积不变)
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子分析:构成的原电池中负极反应式为___ ;溶液中H+移向___ 极(填“正“或“负")。
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。
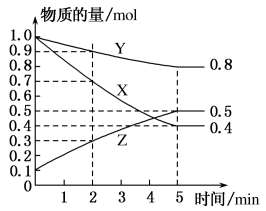
①写出该反应的化学方程式___ 。
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是___ 。
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为___ 。
(1)氮是动植物生长不可缺少的元素,合成氨的反应对人类解决粮食问题贡献巨大,反应如下:N2+3H2
 2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量
2NH3。合成氨反应中的能量变化如图所示,该反应中,反应物化学键断裂吸收的总能量
(2)小王同学为了探究锌与盐酸反应过程中的速率变化,他在200mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 50 | 190 | 414 | 526 | 570 |
①求2~4分钟时间段以盐酸的浓度变化来表示的该反应速率
②小蒋同学认为在盐酸溶液中滴入少量的CuSO4溶液可以加快反应的速率,请从电化学的角度给子分析:构成的原电池中负极反应式为
(3)某温度下在4L恒容密闭容器中,3种气态物质X、Y、Z的物质的量随时间变化曲线如图。

①写出该反应的化学方程式
②在5min时,该反应达到了平衡状态,下列可作为判断反应已达到该状态的是
A.X、Y、Z的浓度相等
B.容器内气体压强保持不变
C.X、Y的反应速率比为3:1
D.生成1molY的同时生成2molZ
③该反应达平衡时,X的转化率为
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
解题方法
【推荐1】用如图所示装置进行中和热的测定实验。
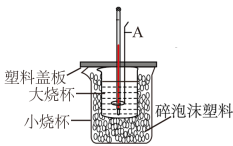
(1)仪器A的名称是________ ,碎泡沫塑料的作用是________________
(2)理论上强酸强碱的中和热为57.3 kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式___________

(1)仪器A的名称是
(2)理论上强酸强碱的中和热为57.3 kJ·mol-1,写出表示稀硫酸和稀NaOH溶液反应的中和热的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
容易
(0.94)
【推荐2】研究氮及其化合物的性质具有极为重要的意义。
(1)NOx是汽车尾气中的主要污染物之一、NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:_______ ,此反应的氧化产物是_______ ,1molNO2反应转移电子_______ mol。
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,写出实验室用固体加热制取NH3的化学方程式为_______ ,用5.35g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为_______ L。(NH4Cl的摩尔质量为53.5g·mol-1)
(3)实验室可以用铜与稀硝酸制取NO,写出该反应的离子方程式:_______ 。
(4)工业上采用氨氧化法制取硝酸,写出在催化剂作用下氨气与氧气反应的化学方程式:__ 。
(5)工业合成氨原料气氢气通过碳与水蒸气反应制取。已知1mol水蒸气和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ 。写出该反应的热化学方程式______ 。
(1)NOx是汽车尾气中的主要污染物之一、NOx能形成酸雨,写出NO2转化为HNO3的化学方程式:
(2)工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2,写出实验室用固体加热制取NH3的化学方程式为
(3)实验室可以用铜与稀硝酸制取NO,写出该反应的离子方程式:
(4)工业上采用氨氧化法制取硝酸,写出在催化剂作用下氨气与氧气反应的化学方程式:
(5)工业合成氨原料气氢气通过碳与水蒸气反应制取。已知1mol水蒸气和炽热的焦炭反应生成水煤气,反应吸热131.4 kJ 。写出该反应的热化学方程式
您最近一年使用:0次
解答题-原理综合题
|
容易
(0.94)
名校
解题方法
【推荐3】在一定条件下,二氧化硫和氧气发生反应:2SO2(g)+O2(g) 2SO3(g)。
2SO3(g)。
(1)降低温度,化学反应速率___ (填“增大”“减小”或“不变”)。
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,反应前15min用SO3表示的平均反应速率为___ 。
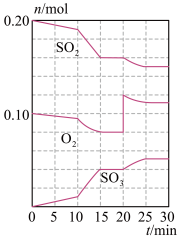
(3)已知0-15min反应放出的总热量为QkJ,写出该反应的热化学方程式____ 。
(4)根据如图判断,10min时改变的反应条件可能是___ (填编号,下同);20min时改变的反应条件可能是____ 。
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O2的物质的量
 2SO3(g)。
2SO3(g)。(1)降低温度,化学反应速率
(2)600℃时,在一容积为2L的密闭容器中,将二氧化硫和氧气混合,在反应进行至10min和20min时,分别改变了影响反应的一个条件,反应过程中SO2、O2、SO3物质的量变化如图所示,反应前15min用SO3表示的平均反应速率为

(3)已知0-15min反应放出的总热量为QkJ,写出该反应的热化学方程式
(4)根据如图判断,10min时改变的反应条件可能是
a.加入催化剂 b.缩小容器容积
c.降低温度 d.增加O2的物质的量
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
【推荐1】用50 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热。回答下列问题:
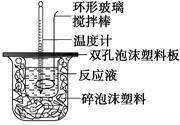
(1)烧杯间填满碎泡沫塑料的作用是___________________________________________________________ ;
(2)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是_____________________________________________________________________ ;
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量____ (填“相等”或“不相等”),若实验操作均正确,则所求中和热_______ (填“相等”或“不相等”);

(1)烧杯间填满碎泡沫塑料的作用是
(2)实验时氢氧化钠溶液的浓度要用0.55 mol/L的原因是
实验中若改用60 mL 0.50 mol/L的盐酸与50 mL 0.55 mol/L的氢氧化钠溶液进行反应,与上述实验相比,所放出的热量
您最近一年使用:0次
解答题-实验探究题
|
容易
(0.94)
解题方法
【推荐2】某学生测定中和反应的反应热,取用50mL0.50mol•L-1的盐酸和50mL0.55mol•L-1的NaOH溶液(密度都是1g•cm-3)。实验中测得的数据如表所示:
(1)反应后溶液的比热容为4.18J/(g•℃)。请利用该学生测得的数据计算生成1molH2O时的反应热:ΔH=_______ 。
(2)该学生测得反应热的数值比57.3kJ•mol-1_______ (填“高”或“低”)。
(3)从下列因素中选出该学生产生实验误差的可能原因_______ 。
A.溶液混合后未及时盖好量热计杯盖
B.倾倒溶液太快,有少量溶液溅出
C.溶液混合后搅拌不够
D.未等温度升到最高值就记录温度计示数
E.用量筒量取盐酸体积时仰视读数
| 实验 次数 | 反应物的温度/℃ | 反应前体系的温度 | 反应后体系的温度 | 温度差 | |
| 盐酸 | NaOH溶液 | t1/℃ | t2/℃ | (t2-t1)/℃ | |
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.5 | 24.5 | 27.5 | 3.00 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(2)该学生测得反应热的数值比57.3kJ•mol-1
(3)从下列因素中选出该学生产生实验误差的可能原因
A.溶液混合后未及时盖好量热计杯盖
B.倾倒溶液太快,有少量溶液溅出
C.溶液混合后搅拌不够
D.未等温度升到最高值就记录温度计示数
E.用量筒量取盐酸体积时仰视读数
您最近一年使用:0次
解答题-原理综合题
|
容易
(0.94)
【推荐1】完成下列填空:
(1) 水解的离子方程式为
水解的离子方程式为_______ ,在配制硫化钠溶液时可以加入少量的_______ (填化学式)以抑制其水解。
(2)硫酸铁水溶液呈_______ 性,原因是_______ 用离子方程式表示)。把 溶液蒸干灼烧,最后得到的主要固体产物是
溶液蒸干灼烧,最后得到的主要固体产物是_______ 。
(3)氢能是一种理想的绿色能源,有科学家预言,氢能有可能成为人类未来的主要能源。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
①适量 在
在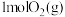 中完全燃烧,生成
中完全燃烧,生成 ,放出
,放出 的热量,请写出表示燃烧热的热化学方程式
的热量,请写出表示燃烧热的热化学方程式_______ 。
②与汽油相比,氢气作为燃料的有点是_______ 。
③下列反应均可获取 。
。
反应I:
反应II: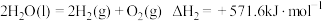
反应III: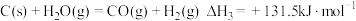
反应IV:
计算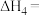
_______ 。
(1)
 水解的离子方程式为
水解的离子方程式为(2)硫酸铁水溶液呈
 溶液蒸干灼烧,最后得到的主要固体产物是
溶液蒸干灼烧,最后得到的主要固体产物是(3)氢能是一种理想的绿色能源,有科学家预言,氢能有可能成为人类未来的主要能源。高纯氢的制备是目前的研究热点,包括氢的制备、储存和应用三个环节。
①适量
 在
在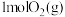 中完全燃烧,生成
中完全燃烧,生成 ,放出
,放出 的热量,请写出表示燃烧热的热化学方程式
的热量,请写出表示燃烧热的热化学方程式②与汽油相比,氢气作为燃料的有点是
③下列反应均可获取
 。
。反应I:

反应II:
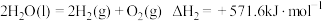
反应III:
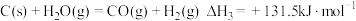
反应IV:

计算
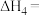
您最近一年使用:0次



