Cu与浓 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
(1)Cu与浓 反应的离子方程式为
反应的离子方程式为_______ 。
(2)关于该实验下列说法错误的是_______ 。
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
【提出猜想】
猜想a: 浓度大
浓度大
猜想b: 溶解在
溶解在 溶液中
溶液中
猜想c:由于 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应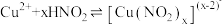 (绿色)
(绿色)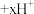
【实验探究】
实验i:配制饱和 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。
实验ii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到_______ ,5min后,溶液完全变为蓝色。
实验iii:取适量Cu与浓 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
对比实验ii与实验iii,可推测 溶液为绿色的原因主要是
溶液为绿色的原因主要是_______ 。
(4)小组同学还针对产物 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。_______ 装置。
②图4为 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为_______ ,继续高温至1000℃生成_______ (填化学式)固体。
 反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。
反应是中学阶段一个重要反应,某兴趣小组对实验中的一些现象及产物进行实验探究。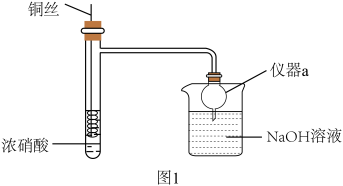
(1)Cu与浓
 反应的离子方程式为
反应的离子方程式为(2)关于该实验下列说法错误的是
A.该反应需要加热才能进行 B.可通过抽动铜丝控制反应的开始和停止
C.反应后迅速生成大量红棕色气体 D.烧杯中仅发生中和反应
(3)小组同学发现Cu与浓
 反应所得混合溶液为绿色,Cu与稀
反应所得混合溶液为绿色,Cu与稀 反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。
反应所得混合溶液为蓝色,针对绿色产生的原因展开探究。【提出猜想】
猜想a:
 浓度大
浓度大猜想b:
 溶解在
溶解在 溶液中
溶液中猜想c:由于
 与水反应能够生成
与水反应能够生成 ,
, 与
与 能够发生可逆反应
能够发生可逆反应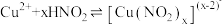 (绿色)
(绿色)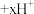
【实验探究】
实验i:配制饱和
 溶液,溶液呈蓝色。
溶液,溶液呈蓝色。实验ii:取适量Cu与浓
 反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到
反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到实验iii:取适量Cu与浓
 反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。
反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。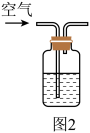
对比实验ii与实验iii,可推测
 溶液为绿色的原因主要是
溶液为绿色的原因主要是(4)小组同学还针对产物
 的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对
的热稳定性进行探究。在如图3所示的实验装置A中,用酒精喷灯对 固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为
固体加强热,产生红棕色气体,在装置C中收集到无色气体,经验证为 。当反应结束以后,试管中残留固体为红色。
。当反应结束以后,试管中残留固体为红色。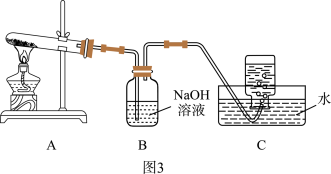
②图4为
 样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。
样品高温过程的热重曲线(样品质量分数w%随温度变化的曲线)。 加热到200℃的化学方程式为
加热到200℃的化学方程式为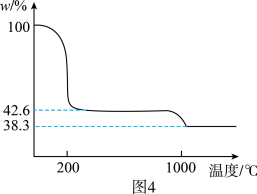
2023·福建泉州·模拟预测 查看更多[5]
福建省泉州第一中学2023届高三毕业班适应性测试化学试题福建省漳州市华安县第一中学2023-2024学年高三上学期开学考试化学试题(已下线)考点16 氮及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)考点4 化学实验方案设计与探究 (核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(新高考专用)(已下线)阶段检测卷二 元素化合物-2025年高考化学一轮复习考点通关卷(新教材新高考)
更新时间:2023/06/06 14:45:50
|
相似题推荐
解答题-实验探究题
|
适中
(0.65)
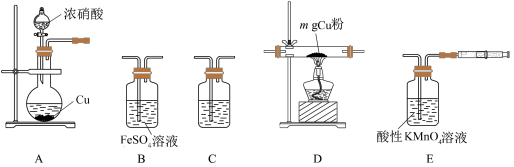
【推荐1】某化学小组设计实验探究是否“NO2能与赤热的铜反应生成氧化铜和氮气”。已知:
Ⅰ.NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO (棕色)
Ⅱ.酸性KMnO4溶液吸收NO生成NO 和Mn2+
和Mn2+
设计实验装置如图所示(各装置中液态试剂均足量)。
(1)该实验装置的连接顺序为:_______ (填装置序号);C装置中盛装试剂是_______ ,其目的是:_______ 。
(2)开始实验时,为排出装置内空气,所要进行的操作是_______ 。
(3)实验过程中,观察到下列现象,请回答:
①B中浅绿色溶液变棕色,得出实验结论是_______ (填代号)。
(a)NO2的还原产物可能有NO
(b)NO2的还原产物一定无NO
(c)NO2的还原产物一定有NO
②E中有紫红色溶液变无色的现象,写出发生反应的离子方程式:_______ 。
(4)当D中铜粉完全反应时停止A中反应,测得反应后D中固体粉末质量为ag。
①当a=_______ (用含 m的代数式表示)时,铜被氧化的产物全部是CuO。
②已知:Cu2O+2H+=Cu+Cu2++H2O,设计下列方案,验证反应后D中固体是否有Cu2O,其中,方案和结论正确的是_______ (填代号)
Ⅰ.NO和FeSO4溶液反应:NO+FeSO4=FeSO4·NO (棕色)
Ⅱ.酸性KMnO4溶液吸收NO生成NO
 和Mn2+
和Mn2+设计实验装置如图所示(各装置中液态试剂均足量)。
(1)该实验装置的连接顺序为:
(2)开始实验时,为排出装置内空气,所要进行的操作是
(3)实验过程中,观察到下列现象,请回答:
①B中浅绿色溶液变棕色,得出实验结论是
(a)NO2的还原产物可能有NO
(b)NO2的还原产物一定无NO
(c)NO2的还原产物一定有NO
②E中有紫红色溶液变无色的现象,写出发生反应的离子方程式:
(4)当D中铜粉完全反应时停止A中反应,测得反应后D中固体粉末质量为ag。
①当a=
②已知:Cu2O+2H+=Cu+Cu2++H2O,设计下列方案,验证反应后D中固体是否有Cu2O,其中,方案和结论正确的是
| 方案 | 操作 | 现象与结论 |
| A | 取少量固体溶于稀硫酸中 | 溶液中有红色固体,则含Cu2O |
| B | 取少量固体溶于稀硝酸中 | 溶液变蓝色,则含Cu2O |
| C | 取少量固体溶于盐酸中 | 溶液变蓝色(或绿色),则含Cu2O |
| D | 取少量固体加热,通入H2,将气体通入无水硫酸铜粉末中 | 白色硫酸铜粉末变蓝色,则含Cu2O |
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐2】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。

【实验过程】
步骤II中,传感器记录数据如图所示:

【解释及结论】
(1)NO2与水反应的离子方程式为____________ 。
(2)步骤I中,通入N2的目的是____________ 。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:____________ 。
(4)该实验验证NO2与水反应产物的实验证据包括____________ (填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D. 传感器记录所得数据
传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果____________

【实验过程】
| 实验步骤 | 实验现象 |
| Ⅰ.打开K1、K3、K5,关闭K2、K4,通入 一段时间N2,关闭K1 | _________ |
| Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3―传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色,_________;片刻后,三颈瓶内的导管口有气泡冒出 |
| III.5min后,打开K4,用注射器将少量氧气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |

【解释及结论】
(1)NO2与水反应的离子方程式为
(2)步骤I中,通入N2的目的是
(3)将步骤II中圆底烧瓶内的实验现象补充完整:
(4)该实验验证NO2与水反应产物的实验证据包括
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.
 传感器记录所得数据
传感器记录所得数据(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
解题方法
【推荐3】碱式碳酸铜是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
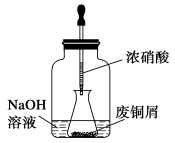
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式___________________________________________ 。
(2)上图装置中NaOH溶液的作用是_________________________ 。
(3)步骤二中,水浴加热所需仪器有________ 、________ (加热、夹持仪器、石棉网除外),水浴加热的优点是_______________________ 。
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。
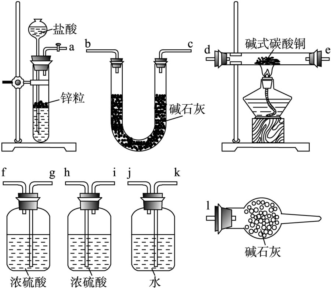
①写出xCuCO3·yCu(OH)2·zH2O与 氢气反应的化学方程式:
氢气反应的化学方程式:__________________ ;
②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )_____
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为______ g,化学式为____________ 。
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?__________ (填“可行”或“不可行”)请说明理由________________________ 。

步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70 ℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式
(2)上图装置中NaOH溶液的作用是
(3)步骤二中,水浴加热所需仪器有
(4) 已知:CuCO3、Cu(OH)2受热均易分解,产物中都有CuO生成。碱式碳酸铜可表示为xCuCO3·yCu(OH)2·zH2O(x、y、z取整数),测定碱式碳酸铜组成的方法有多种,现采用氢气还原法,请回答如下问题:(已知M(Cu)=63.5 g·mol-1)。

①写出xCuCO3·yCu(OH)2·zH2O与
 氢气反应的化学方程式:
氢气反应的化学方程式:②实验装置用上面所有仪器连接而成,按氢气流方向的连接顺序是(填入仪器接口字母编号):( a )→( )( )→( )( )→( )( )→( )( )→( )( )→( l )
③称取23.9 g某碱式碳酸铜样品,充分反应后得到12.7 g残留物,生成4.4 g二氧化碳和7.2 g水。该样品的结晶水质量为
④某同学以氮气代替氢气,并用上述全部或部分仪器来测定碱式碳酸铜的组成,你认为是否可行?
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐1】Ⅰ.Ga(镓)是一种低熔点、高沸点的稀有金属,有“电子工业脊梁”的美誉,GaN被广泛应用到光电子工业和微波通信工业。回答下列问题:
(1)GaN的熔点为1700℃,且熔融状态不导电,据此判断,该化合物是___________ (填“共价”或“离子”)化合物。
(2)已知砷(As)的原子结构示意图为 ,砷元素在元素周期表中的位置是
,砷元素在元素周期表中的位置是___________ 。
(3)已知Ga与As同周期,与Al同主族。下列有关判断正确的是___________ (填选项字母,下同)。
a.酸性: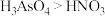 b.热稳定性:
b.热稳定性: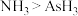
c.与酸反应的剧烈程度:Al>Ga d.原子半径:Ga>As
Ⅱ. 具有还原性,实验室用
具有还原性,实验室用 与
与 在800℃制备氮化铬(CrN)的装置如图所示(部分夹持装置略)。已知:
在800℃制备氮化铬(CrN)的装置如图所示(部分夹持装置略)。已知: 易潮解,在高温下能被
易潮解,在高温下能被 氧化。
氧化。
(4)实验时应先加热装置___________ (填“A”或“C”),装置B的作用是___________ 。
(5)装置C中反应的化学方程式为___________ 。
(6)单向阀F的作用之一是可以防倒吸,下列装置可以起到相同作用的是___________ 。
(1)GaN的熔点为1700℃,且熔融状态不导电,据此判断,该化合物是
(2)已知砷(As)的原子结构示意图为
 ,砷元素在元素周期表中的位置是
,砷元素在元素周期表中的位置是(3)已知Ga与As同周期,与Al同主族。下列有关判断正确的是
a.酸性:
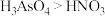 b.热稳定性:
b.热稳定性: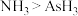
c.与酸反应的剧烈程度:Al>Ga d.原子半径:Ga>As
Ⅱ.
 具有还原性,实验室用
具有还原性,实验室用 与
与 在800℃制备氮化铬(CrN)的装置如图所示(部分夹持装置略)。已知:
在800℃制备氮化铬(CrN)的装置如图所示(部分夹持装置略)。已知: 易潮解,在高温下能被
易潮解,在高温下能被 氧化。
氧化。
(4)实验时应先加热装置
(5)装置C中反应的化学方程式为
(6)单向阀F的作用之一是可以防倒吸,下列装置可以起到相同作用的是

您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐2】工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
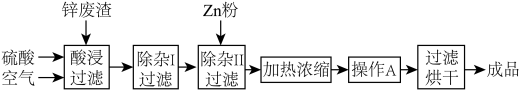
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有________ 。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是_____ 。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为______ 。为控制上述pH范围可选择加入的试剂或药品是________ 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是_______ 。“操作A”的名称是_______ 。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于___________ 。

| 氢氧化物 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 | Zn(OH)2 |
| 开始沉淀的pH | 3.3 | 1.5 | 6.5 | 5.4 |
| 沉淀完全的pH | 5.2 | 3.7 | 9.7 | 8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
名校
【推荐3】氮化锶(Sr3N2)在工业上广泛用于生产荧光粉。锶与氮气在加热条件下可生成氮化锶,氮化锶遇水剧烈反应。某同学设计如下装置制备氮化锶(各装置盛装足量试剂),所使用的氮气样品可能含有少量CO、CO2、O2等气体杂质。
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取
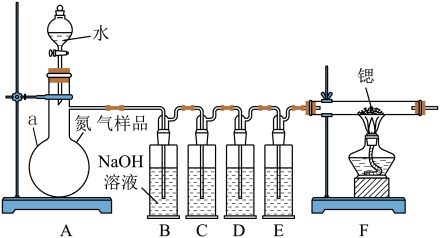
(1)仪器a的名称是__________________ 。
(2)装置C、D、E盛装的试剂分别是_______________ (填代号)。
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案____ 。
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)
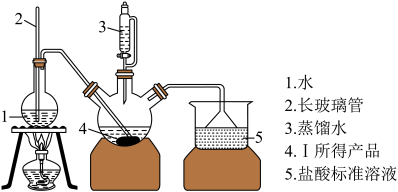
(4)三颈烧瓶中发生反应的化学方程式为_________________________________ 。
(5)装置中长玻璃管的作用原理是_________ 。
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为__________________ 。
(7)产品纯度为_____________ 。(保留三位有效数字)
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是____________ (填字母)。
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
已知:醋酸二氨合亚铜CH3COO[Cu(NH3)2]溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
Ⅰ.氮化锶的制取

(1)仪器a的名称是
(2)装置C、D、E盛装的试剂分别是
甲. 连苯三酚碱性溶液
乙. 浓硫酸
丙. 醋酸二氨合亚铜溶液
(3)该套装置设计存在缺陷,可能会导致产品变质,提出改进方案
Ⅱ.产品纯度的测定
称取6.0 g Ⅰ中所得产品,加入干燥的三颈烧瓶中,然后由恒压滴液漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用200.00 mL 1.00 mol/L的盐酸标准溶液完全吸收(吸收液体积变化忽略不计)。从烧杯中量取20.00 mL的吸收液,用1.00 mol/L NaOH标准溶液滴定过剩的HCl,到终点时消耗16.00 mL NaOH溶液。(图中夹持装置略)

(4)三颈烧瓶中发生反应的化学方程式为
(5)装置中长玻璃管的作用原理是
(6)用1.00 mol/L的NaOH标准溶液滴定过剩的 HCl时所选指示剂为
(7)产品纯度为
(8)下列实验操作可能使氮化锶(Sr3N2)测定结果偏低的是
a.滴定前碱式滴定管未排气泡,滴定后气泡消失
b. 读数时,滴定前平视,滴定后俯视
c. 滴定后,碱式滴定管尖嘴外还悬着一滴液体
您最近一年使用:0次



