高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:___________ ;当有1 mol C参与反应时,该反应转移的电子数是___________ 。
(2)还原炉中发生的化学反应方程式为:___________ 。
(3)上述工艺生产中循环使用的物质除 外,还有
外,还有___________ 。
(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为_________ 。
(5)关于硅及其相关化合物的叙述正确的是_________ 。
A.自然界中存在天然游离的硅单质
B.玻璃、水泥、陶瓷都是传统的硅酸盐产品
C. 既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E.已知C与Si的最高正价都是正四价,由于 ,用类比法得知,
,用类比法得知,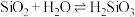

(2)还原炉中发生的化学反应方程式为:
(3)上述工艺生产中循环使用的物质除
 外,还有
外,还有(4)工艺师常用氢氟酸来雕刻玻璃,该反应的化学方程式为
(5)关于硅及其相关化合物的叙述正确的是
A.自然界中存在天然游离的硅单质
B.玻璃、水泥、陶瓷都是传统的硅酸盐产品
C.
 既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物
既能和NaOH溶液反应,又能和氢氟酸反应,所以是两性氧化物D.硅元素在金属与非金属的分界线处,因此具有弱导电性,一般可用于作为半导体材料
E.已知C与Si的最高正价都是正四价,由于
 ,用类比法得知,
,用类比法得知,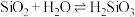
22-23高一下·广东深圳·期中 查看更多[4]
广东省深圳市翠园中学2022-2023学年高一下学期4月期中考试化学试题(已下线)专题突破卷04?非金属及其化合物?-2024年高考化学一轮复习考点通关卷(新教材新高考)(已下线)第03讲 无机非金属材料-【寒假自学课】2024年高一化学寒假提升学与练(人教版2019)福建省宁德市博雅培文学校2023-2024学年高一下学期第一次月考化学试题
更新时间:2023-06-07 21:57:59
|
相似题推荐
填空题
|
适中
(0.65)
名校
【推荐1】(1)某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(a)已知KBrO3在反应中得到电子,则该反应的还原剂是________ 。
(b)已知0.2 mol KBrO3,在反应中得到1 mol电子生成X,则X的化学式为________ 。
(c)根据上述反应可推知________ 。
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若有2molN2生成,有________ mol KNO3被还原,转移电子的物质的量为______ mol,氧化产物是______ ,还原产物是_______ 。
(a)已知KBrO3在反应中得到电子,则该反应的还原剂是
(b)已知0.2 mol KBrO3,在反应中得到1 mol电子生成X,则X的化学式为
(c)根据上述反应可推知
a.氧化性:KBrO3>H3AsO4 b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X d.还原性:X>AsH3
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若有2molN2生成,有
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】氢化亚铜(CuH)是一种难溶物质,用CuSO4溶液和“另一物质”在40~50℃时反应可生成它。CuH具有的性质有:不稳定,易分解;在氯气中能燃烧;与稀盐酸反应能生成气体;Cu+在酸性条件下发生的反应是:2Cu+=Cu2++Cu。根据以上信息,结合自己所掌握的化学知识,回答下列问题:
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作________ (填“氧化剂”或“还原剂”)。
(2)写出CuH在氯气中燃烧的化学反应方程式:___________________________________ 。
(3)CuH溶解在稀盐酸中生成的气体是______ (填化学式)。
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:__________________________________________________ 。
(1)用CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中作
(2)写出CuH在氯气中燃烧的化学反应方程式:
(3)CuH溶解在稀盐酸中生成的气体是
(4)如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________ (填化学式),过氧化钠(Na2O2)中氧元素化合价为_____ 。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________ 。
②每生成1mol FeO42-转移___ mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____ mol。
(3)配平下面化学方程式,回答下列问题:____ C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______ 。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____ L。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:
②每生成1mol FeO42-转移
(3)配平下面化学方程式,回答下列问题:
①H2SO4在上述反应中表现出来的性质是(填选项编号)
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】材料与生产、生活和科技密切相关。回答下列问题:
(1)下列物质中属于复合材料的是___________ (填标号)。
A.钢化玻璃 B.玻璃钢 C.钢筋混凝土 D.水泥
(2)钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,请以氧化物组成的形式表示钾长石的化学式____________ 。
(3)新型无机非金属材料碳化硅陶瓷(SiC)是一种耐高温陶瓷,反应原理为SiO2+3C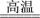 SiC+2CO↑,氧化剂与还原剂的物质的量之比为
SiC+2CO↑,氧化剂与还原剂的物质的量之比为_________ 。
(4)金属材料的应用更是广泛。①工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是________________ 。
②铝热反应可用于冶炼难熔的金属,请写出Al与Cr2O3反应的化学方程式_________ 。
(1)下列物质中属于复合材料的是
A.钢化玻璃 B.玻璃钢 C.钢筋混凝土 D.水泥
(2)钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,请以氧化物组成的形式表示钾长石的化学式
(3)新型无机非金属材料碳化硅陶瓷(SiC)是一种耐高温陶瓷,反应原理为SiO2+3C
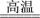 SiC+2CO↑,氧化剂与还原剂的物质的量之比为
SiC+2CO↑,氧化剂与还原剂的物质的量之比为(4)金属材料的应用更是广泛。①工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是
②铝热反应可用于冶炼难熔的金属,请写出Al与Cr2O3反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】按照要求,回答下列问题:
(1)硅酸盐材料是传统无机非金属材料,下列产品属于硅酸盐的是___________ (填序号)。
①玻璃 ②陶瓷 ③水晶 ④硅芯片 ⑤水泥 ⑥光导纤维 ⑦钻石
(2)下列变化中属于吸热反应的是___________ 。
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③甲烷在氧气中的燃烧反应 ④Ba(OH)2·8H2O与NH4Cl反应 ⑤煅烧石灰石 ⑥NH4NO3固体溶于水
(3)已知部分共价键的键能如下:E(N≡N)=946 kJ/mol,E(H-H)=436 kJ/mol,E(N-H)=391kJ/mol。根据以上数据写出工业合成氨的热化学反应方程式:___________ 。
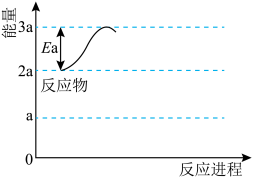
(4)在25℃、101 kPa下,液态甲醇(CH3OH))的燃烧热为726.5 kJ/mol,已知:H2O (l)=H2O(g) △H=+44 kJ/mol,写出甲醇燃烧生成水蒸气的热化学方程式___________ 。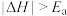 。在右图中补充该反应过程的能量变化示意图
。在右图中补充该反应过程的能量变化示意图___________ 。
(1)硅酸盐材料是传统无机非金属材料,下列产品属于硅酸盐的是
①玻璃 ②陶瓷 ③水晶 ④硅芯片 ⑤水泥 ⑥光导纤维 ⑦钻石
(2)下列变化中属于吸热反应的是
①铝片与稀盐酸的反应 ②将胆矾加热变为白色粉末 ③甲烷在氧气中的燃烧反应 ④Ba(OH)2·8H2O与NH4Cl反应 ⑤煅烧石灰石 ⑥NH4NO3固体溶于水
(3)已知部分共价键的键能如下:E(N≡N)=946 kJ/mol,E(H-H)=436 kJ/mol,E(N-H)=391kJ/mol。根据以上数据写出工业合成氨的热化学反应方程式:
(4)在25℃、101 kPa下,液态甲醇(CH3OH))的燃烧热为726.5 kJ/mol,已知:H2O (l)=H2O(g) △H=+44 kJ/mol,写出甲醇燃烧生成水蒸气的热化学方程式
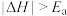 。在右图中补充该反应过程的能量变化示意图
。在右图中补充该反应过程的能量变化示意图
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】地球化学中,通常用热重分析研究矿物在受热时的质量变化以确定其组成。取66.6 mg由高岭石[Al4Si4O10(OH)8]和方解石(CaCO3)组成的矿物,加热到673K~1123K区间内分解为氧化物,样品总失重13.8 mg。高岭石受热分解反应方程式:Al4Si4O10(OH)8 →2Al2O3+4SiO2+4H2O
(1)硅原子核外电子排布在____ 个不同的电子层中,核外最外层电子分布在____ 个不同的轨道中。
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式________ 。
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为_________________ 。
(4)此矿物中高岭石的质量分数为____________ 。
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):_____________________ 。
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl
第二种方法:Si+3HCl SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2 Si+3HCl。
Si+3HCl。
工业上常用第二种方法来提纯单晶硅,其原因是_________________ 。
(1)硅原子核外电子排布在
(2)硅与铝同周期且相邻,化学性质有相似性,写出Si与NaOH溶液反应的化学方程式
(3)高岭石是长石的一种,不同类长石其氧原子的物质的量分数相同。由钙长石化学式CaAl2Si2O8可推知钠长石的化学式为
(4)此矿物中高岭石的质量分数为
a. 44% b. 56% c. 77.5% d. 80%
(5)若对高岭土进行煅烧活化,然后利用盐酸进行分解,对于分解出的氯化铝溶液及二氧化硅再分别加入碱溶液进行去杂提纯,最后得到的氯化铝溶液可制备氧化铝。写出由氯化铝溶液得到纯净氧化铝的化学反应方程式(要求最节约):
(6)用焦炭与石英砂(SiO2)混合高温,产生粗硅,现由两种方法将粗硅提纯:
第一种方法:Si+2Cl2
 SiCl4 SiCl4+2H2
SiCl4 SiCl4+2H2 Si+4HCl
Si+4HCl第二种方法:Si+3HCl
 SiHCl3 SiHCl3+H2
SiHCl3 SiHCl3+H2 Si+3HCl。
Si+3HCl。工业上常用第二种方法来提纯单晶硅,其原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
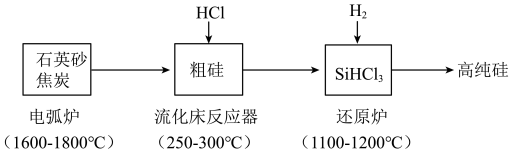
【推荐1】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:___________ 。当有 C参与反应时,该反应转移的电子数目是
C参与反应时,该反应转移的电子数目是___________ 。
(2)还原炉中发生的化学反应方程式为:___________ 。
(3)上述工艺生产中循环使用的物质除Si、 外,还有
外,还有___________ 。
(4)关于硅及其相关化合物的叙述正确的是___________。
 C参与反应时,该反应转移的电子数目是
C参与反应时,该反应转移的电子数目是(2)还原炉中发生的化学反应方程式为:
(3)上述工艺生产中循环使用的物质除Si、
 外,还有
外,还有(4)关于硅及其相关化合物的叙述正确的是___________。
| A.自然界中存在天然游离的硅单质 |
B.光导纤维的主要成分是 |
C.已知C与Si属于主族元素,由于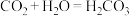 ,用类比法得知, ,用类比法得知,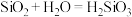 |
| D.硅酸钠的水溶液俗称水玻璃,具有粘性和耐高温,可以作为木材的粘合剂和防火材料 |
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是___ 。
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为___ ,氧化性最弱的简单阳离子是___ 。
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是___ ;制铝时,电解Al2O3而不电解AlCl3的原因是___ 。
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗)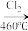 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)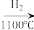 Si(纯)
Si(纯)
写出SiCl4的电子式:___ ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:____ 。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是____ 。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:____ 。
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强 d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是
(4)晶体硅(熔点1410℃)是良好的半导体材料。由粗硅制纯硅过程如下:Si(粗)
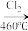 SiCl4
SiCl4 SiCl4(纯)
SiCl4(纯)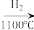 Si(纯)
Si(纯)写出SiCl4的电子式:
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如图:
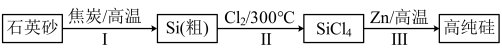
(1)1 mol焦炭在过程Ⅰ中失去___ mol电子。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为___ 。
(3)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为_______ 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是___ 。
(4)Zn还原SiCl4的可逆反应如右:SiCl4(g)+2Zn(s) Si(s)+2ZnCl2(g) △H<0下列说法正确的是
Si(s)+2ZnCl2(g) △H<0下列说法正确的是( )
A.还原过程需在无氧的气氛中进行
B.投入1 mol Zn可生成14 g还原产物
C.增加SiCl4(g)的量,该反应平衡常数不变
D.若SiCl4(g)过量可增大△H的值
(5)有一种由硅制作的材料中常加入Ag2SO4,已知某温度下Ag2SO4(M=312 g/mol)的溶解度为0.624 g/100 gH2O(设溶液体积为水的体积),该温度下Ag2SO4的Ksp=___ (两位有效数字)。
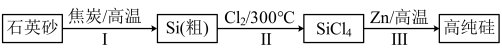
(1)1 mol焦炭在过程Ⅰ中失去
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的离子方程式为
(3)整过生产过程必须严格控制无水,回答下列问题:
①SiCl4遇水剧烈水解生成SiO2和一种酸,化学反应方程式为
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是
(4)Zn还原SiCl4的可逆反应如右:SiCl4(g)+2Zn(s)
 Si(s)+2ZnCl2(g) △H<0下列说法正确的是
Si(s)+2ZnCl2(g) △H<0下列说法正确的是A.还原过程需在无氧的气氛中进行
B.投入1 mol Zn可生成14 g还原产物
C.增加SiCl4(g)的量,该反应平衡常数不变
D.若SiCl4(g)过量可增大△H的值
(5)有一种由硅制作的材料中常加入Ag2SO4,已知某温度下Ag2SO4(M=312 g/mol)的溶解度为0.624 g/100 gH2O(设溶液体积为水的体积),该温度下Ag2SO4的Ksp=
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】氮化硅(Si3N4)可用作高温陶瓷复合材料,在航空航天、汽车发动机、机械等领域有着广泛的应用。由石英砂合成氮化硅粉末的路线如图所示。

其中—NH2中各元素的化合价与NH3相同。
请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:_________________ 。
(2)图示①~⑤的变化中,属于氧化还原反应的是________________ 。
(3)SiCl4在潮湿的空气中剧烈反应,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学方程式为_______________________________________ 。
(4)SiCl4和氨气在1400℃下可以制取氮化硅,反应化学方程式为___________________________ 。
(5)反应①的化学方程式为2C+ SiO2 Si+2CO↑,此反应中若碳充足,可能生成SiC和CO,写出该副反应的化学方程式
Si+2CO↑,此反应中若碳充足,可能生成SiC和CO,写出该副反应的化学方程式_____________________________________ ,其中氧化剂和还原剂的物质的量之比为__________ 。

其中—NH2中各元素的化合价与NH3相同。
请回答下列问题:
(1)石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因:
(2)图示①~⑤的变化中,属于氧化还原反应的是
(3)SiCl4在潮湿的空气中剧烈反应,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学方程式为
(4)SiCl4和氨气在1400℃下可以制取氮化硅,反应化学方程式为
(5)反应①的化学方程式为2C+ SiO2
 Si+2CO↑,此反应中若碳充足,可能生成SiC和CO,写出该副反应的化学方程式
Si+2CO↑,此反应中若碳充足,可能生成SiC和CO,写出该副反应的化学方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】500多年前,一艘载着天然苏打晶体的商船在航行中搁浅,船员们便在附近的沙滩上用几块苏打晶体支锅煮饭。之后他们惊奇地发现,在苏打与沙粒接触处出现了许多晶莹发亮的珠子。回答下列问题:
(1)请你分析一下,这种珠子可能是_______ (填序号,下同)。
A.水晶颗粒 B.无水碳酸钠 C.玻璃珠 D.晶体硅
(2)下列可用来熔融苏打晶体的坩埚是______ 。
A.玛瑙坩埚 B.石英坩埚 C.铁坩埚
(1)请你分析一下,这种珠子可能是
A.水晶颗粒 B.无水碳酸钠 C.玻璃珠 D.晶体硅
(2)下列可用来熔融苏打晶体的坩埚是
A.玛瑙坩埚 B.石英坩埚 C.铁坩埚
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】根据物质的组成、结构、性质进行分类,可预测物质的性质及变化
(1) 是普通玻璃的主要成分,与
是普通玻璃的主要成分,与 一样是酸性氧化物,写出
一样是酸性氧化物,写出 溶于KOH溶液的化学反应方程式
溶于KOH溶液的化学反应方程式_______ 。
(2)物质与水发生的复分解反应称为水解反应。例如: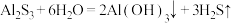 。根据上述观点,写出
。根据上述观点,写出 水解产物的化学式为
水解产物的化学式为_______ 和_______ 。
(3) 固体(黑色)可以写成
固体(黑色)可以写成 ,属于
,属于_______ (填“混合物”或“纯净物”)。将其加入适量盐酸,所发生反应的化学方程式为_______ 。
(4)亚磷酸 分子中虽有三个H原子,已知它与氢氧化钠反只能生成两种盐,请问它属于
分子中虽有三个H原子,已知它与氢氧化钠反只能生成两种盐,请问它属于_______ 元酸,生成的两种盐的化学式为_______ 、_______ 。
(1)
 是普通玻璃的主要成分,与
是普通玻璃的主要成分,与 一样是酸性氧化物,写出
一样是酸性氧化物,写出 溶于KOH溶液的化学反应方程式
溶于KOH溶液的化学反应方程式(2)物质与水发生的复分解反应称为水解反应。例如:
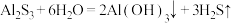 。根据上述观点,写出
。根据上述观点,写出 水解产物的化学式为
水解产物的化学式为(3)
 固体(黑色)可以写成
固体(黑色)可以写成 ,属于
,属于(4)亚磷酸
 分子中虽有三个H原子,已知它与氢氧化钠反只能生成两种盐,请问它属于
分子中虽有三个H原子,已知它与氢氧化钠反只能生成两种盐,请问它属于
您最近一年使用:0次



