设NA为阿伏加德罗常数的值。已知反应:
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=akJ•mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=bkJ•mol-1
其他数据如表所示,下列说法正确的是
①CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H1=akJ•mol-1
②CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H2=bkJ•mol-1
其他数据如表所示,下列说法正确的是
| 化学键 | C=O | O=O | C-H | O-H |
| 键能/(kJ•mol-1) | 798 | x | 413 | 463 |
| A.b<a,且甲烷的摩尔燃烧焓为bkJ•mol-1 |
| B.H2O(g)=H2O(l) △H=(a-b)kJ•mol-1 |
C.上表中x=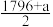 |
| D.当有4NA个C-H键断裂时,反应放出的热量为bkJ |
更新时间:2023-06-15 16:19:19
|
相似题推荐
【推荐1】在298K、101kPa下,将4.4gCO2通入150mL1mol·L-1KOH溶液中充分反应(不考虑气体逸出),测得反应放出akJ的热量,已知该条件下,0.5molCO2通入1L1mol·L-1KOH溶液中充分反应放出bkJ的热量。则下列表示CO2与KOH溶液反应生成KHCO3溶液的热化学方程式书写正确的是
| A.CO2(g)+KOH(aq)=KHCO3(aq) ∆H=-2(5b-a)kJ·mol-1 |
| B.CO2(g)+KOH(aq)=KHCO3(aq) ∆H=-2(5a-4b)kJ·mol-1 |
| C.CO2(g)+KOH(aq)=KHCO3(aq) ∆H=-(20b-a)kJ·mol-1 |
| D.CO2(g)+KOH(aq)=KHCO3(aq) ∆H=-2(10a-b)kJ·mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐2】已知方程式2H2(g) + O2(g)=2H2O(l) △H1=-571.6kJ/mol,则关于方程式H2O(l) = H2(g) +1/2O2(g) △H2=?的说法正确的是
| A.该反应一定不可能发生 | B.该反应△H2=-571.6kJ/mol |
| C.该反应△H2 =+ 285.8 kJ/mol | D.方程式中化学计量数表示分子数 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐3】肼(N2H4)是火箭发动机的燃料,它与N2O4反应生成氮气和水蒸气。已知:
①N2(g)+2O2(g)=N2O4(g) △H=+8.7 kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= - 534.0 kJ/mol
下列表示肼跟N2O4反应的热化学方程式正确的是
①N2(g)+2O2(g)=N2O4(g) △H=+8.7 kJ/mol
②N2H4(g)+O2(g)=N2(g)+2H2O(g) △H= - 534.0 kJ/mol
下列表示肼跟N2O4反应的热化学方程式正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-542.7 kJ/mol |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1076.7 kJ/mol |
| C.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-2153.4 kJ/mol |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) △H=-1059.3 kJ/mol |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】断开(或形成)1mol化学键所吸收(或释放)的能量,叫做该化学键的键能,某些键能数据如下表:估算 的△H约为下列中的
的△H约为下列中的
 的△H约为下列中的
的△H约为下列中的| 化学键 | C O O | O=O | C=O |
| 键能/(kJ·mol) | 1072 | 497.3 | 798 |
| A.-26.7 kJ.mol-1 | B.+26.7 kJ.mol-1 |
| C.-275.35 kJ.mol-1 | D.+275 kJ.mol-1 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】肼 是一种应用广泛的化工原料,可用作火箭发动机的燃料,已知
是一种应用广泛的化工原料,可用作火箭发动机的燃料,已知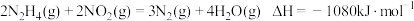 。下列说法正确的是
。下列说法正确的是
 是一种应用广泛的化工原料,可用作火箭发动机的燃料,已知
是一种应用广泛的化工原料,可用作火箭发动机的燃料,已知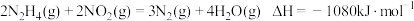 。下列说法正确的是
。下列说法正确的是A.该反应逆反应的活化能 一定大于 一定大于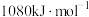 |
B.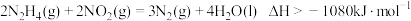 |
| C.该反应反应物的总键能大于生成物的总键能 |
| D.该反应反应物的总能量小于生成物的总能量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
【推荐1】下列各组热化学方程式中,化学反应的ΔH前者小于后者的是
①C(s)+ O2(g) =CO(g);ΔH1 C(s)+O2(g) =CO2(g);ΔH2
O2(g) =CO(g);ΔH1 C(s)+O2(g) =CO2(g);ΔH2
②S(g)+O2(g) =SO2(g);ΔH3 S(s)+O2(g) =SO2(g);ΔH4
③CaO(s)+H2O(l) =Ca(OH)2(s);ΔH5 CaCO3(s) =CaO(s)+CO2(g);ΔH6
①C(s)+
 O2(g) =CO(g);ΔH1 C(s)+O2(g) =CO2(g);ΔH2
O2(g) =CO(g);ΔH1 C(s)+O2(g) =CO2(g);ΔH2②S(g)+O2(g) =SO2(g);ΔH3 S(s)+O2(g) =SO2(g);ΔH4
③CaO(s)+H2O(l) =Ca(OH)2(s);ΔH5 CaCO3(s) =CaO(s)+CO2(g);ΔH6
| A.② | B.①② | C.①③ | D.②③ |
您最近一年使用:0次
【推荐2】下列说法或表示法正确的是
| A.H2(g)+Cl2(g)=2HCl(g)要在光照和点燃条件下才反应,所以△H>0,△S<0。 |
| B.由C(s,石墨)=C(s,金刚石);△H=+1.19kJ·mol-1可知,金刚石比石墨稳定 |
| C.在稀溶液中:H+(aq)+OH-(aq)=H2O(1);△H=-57.3kJ·mol-1,若将0.5mol/L的H2SO4溶液1mol/L的NaOH溶液等体积混合,放出的热量等于57.3kJ |
| D.乙醇的燃烧热△H=-1366.8kJ·mol-1,在25℃、101kPa时,92g乙醇充分燃烧后放出2733.6kJ热量 |
您最近一年使用:0次

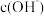 为
为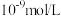
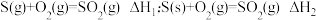 ,则
,则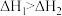
 、
、 一定能大量共存
一定能大量共存

