Ⅰ.某研究小组利用如图1所示装置探究金属Fe的腐蚀与防护条件{已知Fe2+遇K3[Fe(CN)6]溶液生成蓝色沉淀}。反应一段时间后,分别向①区和②区的Cu电极附近滴加酚酞试液,向①区和②区的Fe电极附近滴加K3[Fe(CN)6]溶液。

(1)①区在Cu电极附近,②区Fe电极附近可观察到的现象分别是_______ 、_______ ,④区Zn电极的电极反应式为_______ 。
(2)上述①③两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对不活泼的金属被保护,根据此原理采取的金属防护方法称为_______ 。
Ⅱ.某研究小组又利用图2装置制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH- Fe
Fe +3H2↑。装置通电后,铁电极附近生成紫红色Fe
+3H2↑。装置通电后,铁电极附近生成紫红色Fe ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。

已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(3)电解过程中须将阴极产生的气体及时排出,其原因是_______ 。
(4)c(Na2FeO4)随初始c(NaOH)的变化如图3所示。
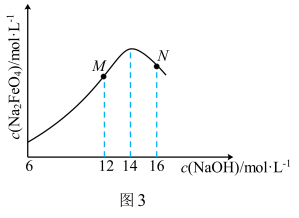
M、N两点的c(Na2FeO4)均低于最高值的原因是_______ 。

(1)①区在Cu电极附近,②区Fe电极附近可观察到的现象分别是
(2)上述①③两个实验表明,活泼性不同的两种金属作电极构成原电池时,一般是相对不活泼的金属被保护,根据此原理采取的金属防护方法称为
Ⅱ.某研究小组又利用图2装置制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH-
 Fe
Fe +3H2↑。装置通电后,铁电极附近生成紫红色Fe
+3H2↑。装置通电后,铁电极附近生成紫红色Fe ,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。
已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
(3)电解过程中须将阴极产生的气体及时排出,其原因是
(4)c(Na2FeO4)随初始c(NaOH)的变化如图3所示。

M、N两点的c(Na2FeO4)均低于最高值的原因是
更新时间:2023-10-12 22:27:36
|
相似题推荐
填空题
|
较易
(0.85)
解题方法
【推荐1】根据《化学反应原理》中相关知识,按要求作答。
氯的单质、化合物与人类生产、生活和科研密切相关。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+Cl2(g)=2HCl(g)△H = -184.6 kJ . mol-1,判断该反应属于_____ (填“吸热”或“放热")反应。
(2)盐酸是一种强酸,补充完整电离方程式:HCl=___ +Cl- 。室温下,将大小相等的镁条和铁片投入同浓度的稀盐酸中,产生氢气的速率较大的是________ 。
(3)84消毒液在防控新冠肺炎疫情中被大量使用,它是利用氯气与氢氧化钠溶液反应制成的.反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
①该反应____ (填“是”或“不是”)氧化还原反应。
②室温下,84消毒液呈碱性,其pH___ 7 (填“>”或“<”)。
③84消毒液的有效成分NaClO,水解的离子方程式:ClO-+H2O=HClO+OH-,生成物中__ 具有很强的氧化性,可以使病毒和细菌失去生理活性;水解是吸热反应,升高温度平衡向_____ (填“正反应”或“逆反应”)方向移动。
(4)电解熔融氯化钠可制取金属钠和氯气,装置如图所示(电极不参与反应):

通电时,Na+向______ (填“阳极”或“阴极")移动,写出生成金属钠的电极反应式:______ 。
氯的单质、化合物与人类生产、生活和科研密切相关。
(1)在一定条件下,氢气在氯气中燃烧的热化学方程式: H2(g)+Cl2(g)=2HCl(g)△H = -184.6 kJ . mol-1,判断该反应属于
(2)盐酸是一种强酸,补充完整电离方程式:HCl=
(3)84消毒液在防控新冠肺炎疫情中被大量使用,它是利用氯气与氢氧化钠溶液反应制成的.反应方程式为Cl2+2NaOH=NaCl+NaClO+H2O。
①该反应
②室温下,84消毒液呈碱性,其pH
③84消毒液的有效成分NaClO,水解的离子方程式:ClO-+H2O=HClO+OH-,生成物中
(4)电解熔融氯化钠可制取金属钠和氯气,装置如图所示(电极不参与反应):

通电时,Na+向
您最近半年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐2】某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中溶质足量),当闭合该装置的电键K时,观察到电流计的指针发生了偏转。请回答下列问题:
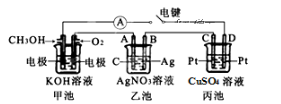
(1)丙池为________ (填原电池、电解池或电镀池),通入甲醇电极的电极反应式为____________________ 。
(2)乙池中A电极为________ (填“正极”、“负极”、“阴极”或“阳极”),该池的总反应化学方程式为_________________________ 。
(3)当乙池中B极质量增重10.8g时,甲池中理论上消耗 的体积为
的体积为________ mL(标准状况)。
(4)丙池中,C上的电极反应式为____________________ 。如果起始时盛有1000mL  的硫酸铜溶液(25℃,
的硫酸铜溶液(25℃, 足量),一段时间后,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入4g氧化铜,则加入氧化铜之前溶液的pH变为
足量),一段时间后,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入4g氧化铜,则加入氧化铜之前溶液的pH变为________ 。

(1)丙池为
(2)乙池中A电极为
(3)当乙池中B极质量增重10.8g时,甲池中理论上消耗
 的体积为
的体积为(4)丙池中,C上的电极反应式为
 的硫酸铜溶液(25℃,
的硫酸铜溶液(25℃, 足量),一段时间后,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入4g氧化铜,则加入氧化铜之前溶液的pH变为
足量),一段时间后,若要使溶液恢复到起始浓度(温度不变,忽略溶液体积的变化),可向溶液中加入4g氧化铜,则加入氧化铜之前溶液的pH变为
您最近半年使用:0次
填空题
|
较易
(0.85)
【推荐3】I.微型纽扣电池在现代生活中应用广泛。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液,总反应式为Ag2O+Zn=ZnO+2Ag。
(1)Zn是_______ 极,发生_______ 反应,该电池的正极反应式为_______ 。
(2)电池内部电流方向是从_______ (填“Ag2O”或“Zn”,下同)极流向_______ 极,当外电路中有1mole-通过时,负极消耗的物质的质量是_______ g。
II.用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。

(3)A中发生反应的总化学方程式为_______ 。
(4)B中石墨电极上的电极反应式为_______ ;一段时间后,B中溶液pH_______ (填“升高”、“降低”或“不变”)。
(1)Zn是
(2)电池内部电流方向是从
II.用如图所示的装置进行电解,A中盛有NaCl溶液,B中盛有饱和Na2SO4溶液,通电一会儿,发现湿润的淀粉KI试纸的D端变为蓝色。

(3)A中发生反应的总化学方程式为
(4)B中石墨电极上的电极反应式为
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq) 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如图装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如图装置设计实验,识别出此铅蓄电池的正、负极。

(1)将A接E、B接F,B电极出现_____________ 现象,电极反应式为_____________ ,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________ ,充电时该极与外接电源的_____________ 极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______ mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。

①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____ 色,铅笔芯c点处的电极反应式为________________ 。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______ (填“E”或“F”)电极。
 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如图装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如图装置设计实验,识别出此铅蓄电池的正、负极。
(1)将A接E、B接F,B电极出现
(2)铅蓄电池工作时(放电),E电极的反应式为
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。

①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】请按要求回答下列问题。

(1)根据图1回答①②:
①打开K2,闭合K1。A极现象___ ,B极的电极反应式为___ 。
②打开K1,闭合K2。A极可观察到的现象是__ 。
(2)根据图2回答③④:③电解反应的离子方程式为__ 。
④实验完成后,铜电极增重ag,石墨电极产生标准状况下的气体体积__ L。

(1)根据图1回答①②:
①打开K2,闭合K1。A极现象
②打开K1,闭合K2。A极可观察到的现象是
(2)根据图2回答③④:③电解反应的离子方程式为
④实验完成后,铜电极增重ag,石墨电极产生标准状况下的气体体积
您最近半年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】化学电池在通讯,交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值,在酸性土壤中这种污染尤为严重。这是因为___________________ 。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为Cd+2NiO(OH)+2H2O
 2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是
2Ni(OH)2+Cd(OH)2。已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是①以上反应是可逆反应 ②以上反应不是可逆反应
③充电时化学能转变为电能 ④放电时化学能转变为电能
| A.①③ | B.②④ |
| C.①④ | D.②③ |
您最近半年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐1】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为______________ 。
(2)利用如图装置,可以模拟铁的电化学防护。
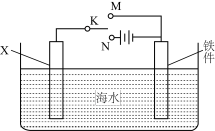
①若X为碳棒,则为减缓铁件的腐蚀,开关K应置于__________ 处。
②若X为锌,开关K置于M处,则该电化学防护法称为______________ 。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为
(2)利用如图装置,可以模拟铁的电化学防护。

①若X为碳棒,则为减缓铁件的腐蚀,开关K应置于
②若X为锌,开关K置于M处,则该电化学防护法称为
您最近半年使用:0次
填空题
|
较易
(0.85)
【推荐2】2020年3月22日为第 28届世界水日,化学中有很多与水相关的化学知识。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌_______ 。(填“锌块”或“铜块”)
(2)自来水厂常用含有 Fe3+的净水剂净水,其原理是_________ 。(用离子方程式表示)
(3)自来水常用氯气杀菌消毒,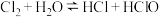 ,要增大 HClO 的浓度,可以加入下列物质中的
,要增大 HClO 的浓度,可以加入下列物质中的____ 。
A.CH3COONa B.HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH-)=______ mol·L-1。
(1)海水会腐蚀铁质海轮外壳,制造海轮时会在船底四周镶嵌
(2)自来水厂常用含有 Fe3+的净水剂净水,其原理是
(3)自来水常用氯气杀菌消毒,
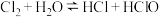 ,要增大 HClO 的浓度,可以加入下列物质中的
,要增大 HClO 的浓度,可以加入下列物质中的A.CH3COONa B.HCl C.CaCO3固体 D.H2O E.SO2
(4)常温下,0.01mol·L-1NaOH溶液,由水电离出的c(OH-)=
您最近半年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】《我在故宫修文物》这部纪录片里关于古代青铜器的修复引起了某研学小组的兴趣。“修旧如旧”是文物保护的主旨。

(1)查阅资料得知铜锈为 Cu2(OH)2CO3, 俗称铜绿,可溶于酸。请写出铜绿与盐酸反应的化学方程式___________
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)2Cl。考古学家将铜锈分为无害锈和有密锈,结构如图所示:
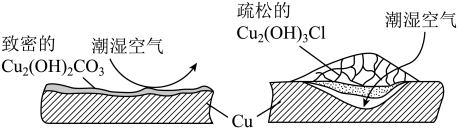
①Cu2(OH)2CO3可否作无害锈,请解释原因。___________
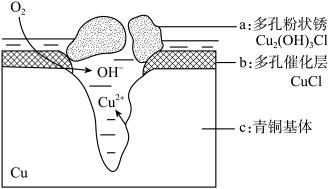
②如图为青铜器在潮湿环境中发生电化学腐蚀生成有害锈Cu2(OH) Cl的原理示意图:
(3)若生成2.145 g Cu2(OH)3Cl (式量:214.5),计算理论上消耗标准状况氧气体积___________ L。
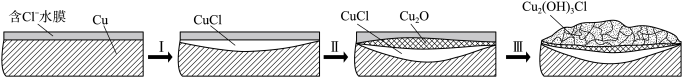
(4)文献显示有害锈的形成过程中会产生 CuCl(白色不溶于水的固体):
写出过程Ⅰ中负极的电极反应式___________ 。
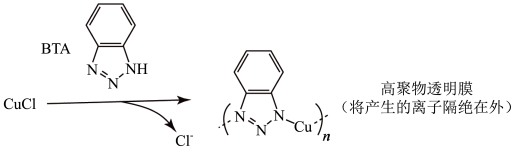
(5)BTA保护法是青铜器的修复最常用的方法之一,原理如图所示:
请分析BTA保护法可能的优点(请写出2点)___________ 。
(6)金属腐蚀会造成很严重的事故和损失。2020 年广东省虎门大桥出现桥面抖动现象,专家对桥墩的主体钢筋进行了全面检测,并确定了其安全性。以下说法正确的是___________

(1)查阅资料得知铜锈为 Cu2(OH)2CO3, 俗称铜绿,可溶于酸。请写出铜绿与盐酸反应的化学方程式
(2)继续查阅中国知网,了解到铜锈的成分非常复杂,主要成分有Cu2(OH)2CO3和Cu2(OH)2Cl。考古学家将铜锈分为无害锈和有密锈,结构如图所示:

①Cu2(OH)2CO3可否作无害锈,请解释原因。
②如图为青铜器在潮湿环境中发生电化学腐蚀生成有害锈Cu2(OH) Cl的原理示意图:

(3)若生成2.145 g Cu2(OH)3Cl (式量:214.5),计算理论上消耗标准状况氧气体积
(4)文献显示有害锈的形成过程中会产生 CuCl(白色不溶于水的固体):

写出过程Ⅰ中负极的电极反应式
(5)BTA保护法是青铜器的修复最常用的方法之一,原理如图所示:

请分析BTA保护法可能的优点(请写出2点)
(6)金属腐蚀会造成很严重的事故和损失。2020 年广东省虎门大桥出现桥面抖动现象,专家对桥墩的主体钢筋进行了全面检测,并确定了其安全性。以下说法正确的是___________
| A.桥墩钢筋容易发生化学腐蚀 |
| B.在海面与空气交界处的钢铁,比海水中的钢铁更容易被腐蚀 |
| C.可以在桥墩钢铁上嵌附铜片,减慢其腐蚀速率 |
| D.将桥墩钢铁与外接电源负极相连的方法,称为牺牲阳极的阴极保护法 |
您最近半年使用:0次



