电池和电解池在日常生活中有着广泛的应用。根据所学知识完成下列题目。
Ⅰ.电化学装置如图所示
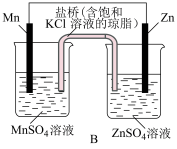
(1)已知金属活泼性: 。若装置B中负极金属的消耗速率为
。若装置B中负极金属的消耗速率为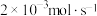 ,则盐桥中
,则盐桥中 流向
流向___________ (填“ ”或“
”或“ ”)溶液的迁移速率为
”)溶液的迁移速率为___________  。
。
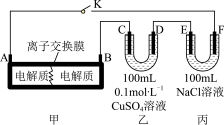
Ⅱ.电解饱和食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:
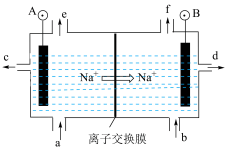
(2)①电解饱和食盐水的总反应的离子方程式是___________ 。
②在b口加入的物质为___________ (写化学式)
(3)氨气是一种富氢燃料,可以直接用于燃料电池,供氨水式燃料电池工作原理如图2所示:
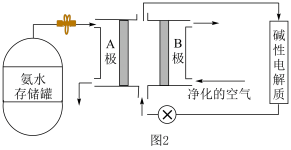
①“净化的空气”是指在进入电池装置前除去___________ (填化学式)的气体。
②氨气燃料电池的反应原理是氨气与氧气反应生成一种常见的无毒气体和水,该电池正极上的电极反应式是___________ 。
Ⅲ.如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为 ,图中的离子交换膜只允许
,图中的离子交换膜只允许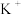 通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少1.28g。
通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少1.28g。
(4)装置甲中A电极为电池的___________ 极,B电极的电极反应式为___________ 。
(5)装置乙中D电极产生的气体是___________ (写化学式),体积为___________ mL(标准状况)。
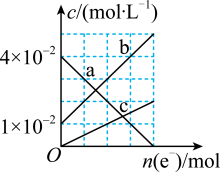
(6)若将装置丙中的 溶液改换成
溶液改换成 和
和 的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。图中生成b的电极反应式是
的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。图中生成b的电极反应式是___________ 。
Ⅰ.电化学装置如图所示

(1)已知金属活泼性:
 。若装置B中负极金属的消耗速率为
。若装置B中负极金属的消耗速率为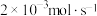 ,则盐桥中
,则盐桥中 流向
流向 ”或“
”或“ ”)溶液的迁移速率为
”)溶液的迁移速率为 。
。Ⅱ.电解饱和食盐水是氯碱工业的基础。目前比较先进的方法是阳离子交换膜法,电解示意图如图所示,图中的阳离子交换膜只允许阳离子通过,请回答以下问题:

(2)①电解饱和食盐水的总反应的离子方程式是
②在b口加入的物质为
(3)氨气是一种富氢燃料,可以直接用于燃料电池,供氨水式燃料电池工作原理如图2所示:

①“净化的空气”是指在进入电池装置前除去
②氨气燃料电池的反应原理是氨气与氧气反应生成一种常见的无毒气体和水,该电池正极上的电极反应式是
Ⅲ.如图装置甲是某可充电电池的示意图,该电池放电的化学方程式为
 ,图中的离子交换膜只允许
,图中的离子交换膜只允许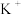 通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少1.28g。
通过,C、D、F均为石墨电极,E为铜电极。工作一段时间后,断开K,此时C、D两电极产生的气体体积相同,E电极质量减少1.28g。
(4)装置甲中A电极为电池的
(5)装置乙中D电极产生的气体是
(6)若将装置丙中的
 溶液改换成
溶液改换成 和
和 的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。图中生成b的电极反应式是
的混合溶液。从反应初始至反应结束,丙装置溶液中金属阳离子物质的量浓度与转移电子的物质的量的变化关系如图所示。图中生成b的电极反应式是
更新时间:2023-10-16 22:59:04
|
相似题推荐
填空题
|
较难
(0.4)
【推荐1】氯酸是一种强酸,氯酸的浓度超过40%,就会迅速分解,反应的化学方程式为:
8HClO3→ 3O2↑+ 2Cl2↑+ 4HClO4+ 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:_________ →___________ (填化学式)。
该反应的氧化产物是____________ (填化学式);所得混合气体的平均式量为_______ 。
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为____________________________ 。若将该反应设计成原电池,则在正极生成的离子是___________ (填离子名称)
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是_________ (填序号)。
a. KMnO4> Cl2 b. Cl2> O2 c. HIO4> HClO3 d. HIO4> Cl2
8HClO3→ 3O2↑+ 2Cl2↑+ 4HClO4+ 2H2O。
(1)在上述变化过程中,发生还原反应的过程是:
该反应的氧化产物是
(2)已知测定锰的一种方法是:将锰离子转化为高锰酸根离子。反应体系中有H+、Mn2+、H2O、IO3—、MnO4—、IO4—离子,该离子反应方程式为
(3)综合上述各反应及已有知识,可推知氧化性强弱关系正确的是
a. KMnO4> Cl2 b. Cl2> O2 c. HIO4> HClO3 d. HIO4> Cl2
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】某研究小组用微生物电池模拟淡化海水,同时做电解实验,实验装置如下图所示,C、D是铂电极。
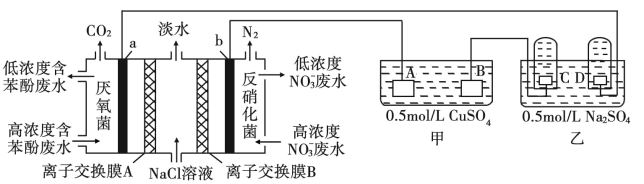
(1)若A、B是惰性电极
①写出D极的电极反应式_______ 。
②写出甲中总反应的离子方程式_______ 。
(2)若甲是铁片镀铜装置,A、B质量相同。当B和A的质量差为12.8g时,C极产生的气体在标准状况下的体积是_______ L。
(3)苯酚的分子式为 。
。
①离子交换膜A为_______ 离子交换膜(填“阴”或“阳”)。
②a极的电极反应式为_______ 。
③理论上每消除1mol苯酚,同时消除_______ mol  ;当电路中转移1mol电子时,模拟海水理论上除盐
;当电路中转移1mol电子时,模拟海水理论上除盐_______ g。

(1)若A、B是惰性电极
①写出D极的电极反应式
②写出甲中总反应的离子方程式
(2)若甲是铁片镀铜装置,A、B质量相同。当B和A的质量差为12.8g时,C极产生的气体在标准状况下的体积是
(3)苯酚的分子式为
 。
。①离子交换膜A为
②a极的电极反应式为
③理论上每消除1mol苯酚,同时消除
 ;当电路中转移1mol电子时,模拟海水理论上除盐
;当电路中转移1mol电子时,模拟海水理论上除盐
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】电解质溶液A:25g CuSO4·5H2O + 4mL浓H2SO4 + 200mL H2O
电解质溶液B:16g CuCl+ 100mL浓HCIl+ 100mL H2O + 4g铜粉
以铜为电极,通电电解串连的两个电解槽(分别盛电解质溶液A和电解质溶液B)。正极质量改变如下表所示:
(1)正极质量改变不同的原因_______ 。
(2)电解质液中加铜粉的原因是_______ 。
(3)从理论上讲,电解过程铜粉质量不会改变,为什么?实际情况如何_______ 。
电解质溶液B:16g CuCl+ 100mL浓HCIl+ 100mL H2O + 4g铜粉
以铜为电极,通电电解串连的两个电解槽(分别盛电解质溶液A和电解质溶液B)。正极质量改变如下表所示:
| 电解前质量/g | 电解后质量/g | 改变量/g | ||
| 电解质液A | 正极 | 7.4 | 7.3 | -0.1 |
| 负极 | 7.5 | 7.6 | 0.1 | |
| 电解质液B | 正极 | 7.4 | 7.2 | -0.2 |
| 负极 | 7.3 | 7.5 | 0.2 |
(1)正极质量改变不同的原因
(2)电解质液中加铜粉的原因是
(3)从理论上讲,电解过程铜粉质量不会改变,为什么?实际情况如何
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可表示为:Cd+2NiO(OH)十2H2O 2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是
2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是____________________ ,负极的反应式是_________________ 。
(2)一种熔融碳酸盐燃料电池原理示意如图: 电池工作时,外电路上电流的方向应从电极___ (“填A或B”)流向用电器。内电路中,CO32-向电极_____ (“填A或B”)移动,电极A上CO参与的电极反应为______________________ 。
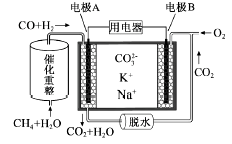
(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的电极是原电池的____ 极,该极的电极反应式是____________________ ,电池工作时的总反应的离子方程式是__________________ 。如果消耗甲烷160g,假设化学能完全转化为电能,则转移电子的数目为___________ (用NA表示),需要消耗标准状况下氧气的体积为_______ L。
 2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是
2 Ni(OH)2+ Cd(OH)2,已知Ni(OH)2和Cd(OH)2均难于溶水但能溶于酸。正极的反应式是(2)一种熔融碳酸盐燃料电池原理示意如图: 电池工作时,外电路上电流的方向应从电极

(3)将两铂片插入KOH溶液中作为电极,在两极区分别通入甲烷和氧气构成燃料电池,则通入甲烷气体的电极是原电池的
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
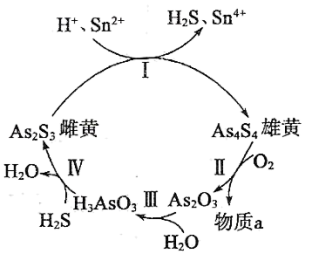
【推荐2】砷 在自然界中存在的主要化合物有砒霜
在自然界中存在的主要化合物有砒霜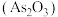 、雄黄
、雄黄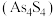 、雌黄
、雌黄 等.
等.
(1)已知 时,
时, 、
、 和
和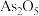 之间焓变的实验数据如图所示,写出
之间焓变的实验数据如图所示,写出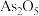 分解为
分解为 的热化学方程式
的热化学方程式______ .

(2)雌黄和雄黄早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药.在一定条件下,雌黄和雄黄的转化关系如图所示.
①反应Ⅰ中, 和
和 恰好完全反应时,其物质的量之比为
恰好完全反应时,其物质的量之比为____________ .
②反应Ⅱ中,若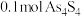 参加反应,转移
参加反应,转移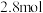 电子,则物质a为
电子,则物质a为_______ (填化学式).
(3)亚砷酸 可以用于治疗白血病,其溶液中存在多种含砷微粒形态.常温下,用
可以用于治疗白血病,其溶液中存在多种含砷微粒形态.常温下,用 溶液滴定
溶液滴定 时,含砷微粒的物质的量分数随
时,含砷微粒的物质的量分数随 的变化如图所示.
的变化如图所示.

① 由7调至10的过程中发生反应的离子方程式为
由7调至10的过程中发生反应的离子方程式为____________ .
②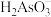 的水解平衡常数
的水解平衡常数
___________ .
(4)砷酸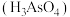 具有较强的氧化性.某实验小组依据反应
具有较强的氧化性.某实验小组依据反应 设计如图原电池,探究
设计如图原电池,探究 对
对 氧化性的影响,测得电压与
氧化性的影响,测得电压与 的关系如图所示.则a点时,盐桥中
的关系如图所示.则a点时,盐桥中
_______ 移动(填“向左”、“向右”或“不”),c点时,负极的电极反应式为__________ .

 在自然界中存在的主要化合物有砒霜
在自然界中存在的主要化合物有砒霜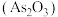 、雄黄
、雄黄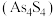 、雌黄
、雌黄 等.
等.(1)已知
 时,
时, 、
、 和
和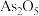 之间焓变的实验数据如图所示,写出
之间焓变的实验数据如图所示,写出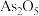 分解为
分解为 的热化学方程式
的热化学方程式
(2)雌黄和雄黄早期都曾用作绘画颜料,又都因有抗病毒疗效而用来入药.在一定条件下,雌黄和雄黄的转化关系如图所示.
①反应Ⅰ中,
 和
和 恰好完全反应时,其物质的量之比为
恰好完全反应时,其物质的量之比为②反应Ⅱ中,若
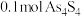 参加反应,转移
参加反应,转移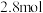 电子,则物质a为
电子,则物质a为
(3)亚砷酸
 可以用于治疗白血病,其溶液中存在多种含砷微粒形态.常温下,用
可以用于治疗白血病,其溶液中存在多种含砷微粒形态.常温下,用 溶液滴定
溶液滴定 时,含砷微粒的物质的量分数随
时,含砷微粒的物质的量分数随 的变化如图所示.
的变化如图所示.
①
 由7调至10的过程中发生反应的离子方程式为
由7调至10的过程中发生反应的离子方程式为②
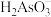 的水解平衡常数
的水解平衡常数
(4)砷酸
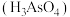 具有较强的氧化性.某实验小组依据反应
具有较强的氧化性.某实验小组依据反应 设计如图原电池,探究
设计如图原电池,探究 对
对 氧化性的影响,测得电压与
氧化性的影响,测得电压与 的关系如图所示.则a点时,盐桥中
的关系如图所示.则a点时,盐桥中

您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐3】已知装置E是在石墨电极上镀银,回答下列问题:
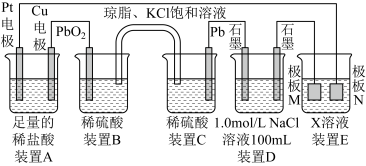
(1)装置A中Pt电极的名称为_______ (填“正极”、“负极”、“阴极”或“阳极”),装置A总反应的离子方程式为_______ 。
(2)装置B中电极上发生的电极反应为_______ ;盐桥中K+移向装置_______ (填“B”或“C”)。
(3)当装置D共收集到标况下5.6 L气体时,电路中通过的电子的物质的量为_______ mol。
(4)装置E中X为_______ ,极板M的材料为_______ 。

(1)装置A中Pt电极的名称为
(2)装置B中电极上发生的电极反应为
(3)当装置D共收集到标况下5.6 L气体时,电路中通过的电子的物质的量为
(4)装置E中X为
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐1】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的三种方法:
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是_______ 。
(2)已知:2Cu(s)+ O2(g)=Cu2O(s) △H = -akJ·mol-1
O2(g)=Cu2O(s) △H = -akJ·mol-1
C(s)+ O2(g)=CO(g) △H = -bkJ·mol-1
O2(g)=CO(g) △H = -bkJ·mol-1
Cu(s)+ O2(g)=CuO(s) △H = -ckJ·mol-1
O2(g)=CuO(s) △H = -ckJ·mol-1
则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =_______ kJ·mol-1。
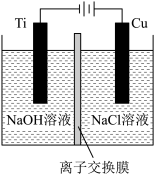
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为_______ 。
(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为_______ 。
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验: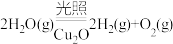 △H >0
△H >0
水蒸气的浓度随时间t变化如下表所示。
下列叙述正确的是_______ (填字母代号)。
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
| 方法Ⅰ | 用炭粉在高温条件下还原CuO |
| 方法Ⅱ | 电解法,反应为2Cu + H2O  Cu2O + H2↑。 Cu2O + H2↑。 |
| 方法Ⅲ | 用肼(N2H4)还原新制Cu(OH)2 |
(1)工业上常用方法Ⅱ和方法Ⅲ制取Cu2O而很少用方法Ⅰ,其原因是
(2)已知:2Cu(s)+
 O2(g)=Cu2O(s) △H = -akJ·mol-1
O2(g)=Cu2O(s) △H = -akJ·mol-1C(s)+
 O2(g)=CO(g) △H = -bkJ·mol-1
O2(g)=CO(g) △H = -bkJ·mol-1Cu(s)+
 O2(g)=CuO(s) △H = -ckJ·mol-1
O2(g)=CuO(s) △H = -ckJ·mol-1则方法Ⅰ发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H =
(3)方法Ⅱ采用离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图所示,该电池的阳极反应式为

(4)方法Ⅲ为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2。该制法的化学方程式为
(5)在相同的密闭容器中,用以上两种方法制得的Cu2O分别进行催化分解水的实验:
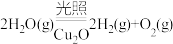 △H >0
△H >0水蒸气的浓度随时间t变化如下表所示。
| 序号 | 0 | 10 | 20 | 30 | 40 | 50 | |
| ① | T1 | 0.050 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
| ② | T1 | 0.050 | 0.0488 | 0.0484 | 0.0480 | 0.0480 | 0.0480 |
| ③ | T2 | 0.10 | 0.094 | 0.090 | 0.090 | 0.090 | 0.090 |
下列叙述正确的是
A.实验的温度:T2<T1
B.实验①前20 min的平均反应速率 v(O2)=7×10-5 mol·L-1 min-1
C.实验②比实验①所用的催化剂催化效率高
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336ml(标准状况)气体。回答下列问题:

(1)根据图中c、d两极上产生气体的体积判断电源N极为_______ 极(填“正”或“负),电解池中a为______ 极。请写出a极的电极反应式:___________________ .
(2) AgNO3溶液的浓度________ (填“增大”“减小”或“不变”,下同),AgNO3溶液的pH_________ ,H2SO4溶液的浓度__________ ,H2SO4溶液的pH________ .
(3)上述过程中通过电路的电子______ mol.
(4)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有的5.00%溶液为____ g.

(1)根据图中c、d两极上产生气体的体积判断电源N极为
(2) AgNO3溶液的浓度
(3)上述过程中通过电路的电子
(4)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有的5.00%溶液为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的印刷电路板铜箔。某工程师为了从使用过的腐蚀废液中回收铜,并重新获得FeCl3溶液,准备采用下列流程:

(1)写出流程①中回收金属铜时发生反应的离子方程式 .
请根据上述反应设计一个原电池,在方框中画出简易装置图(标出相应电极名称、电极材料、电解质溶液).
(2)写出图流程③相关反应的化学方程式: .
(3)如下图为相互串联的甲、乙两个电解池(A、B电极都是惰性电极)
请回答:
①写出两电解池中的电解反应方程式:
甲__________________________________________________
乙
②若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为______________。
③若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为____________。

(1)写出流程①中回收金属铜时发生反应的离子方程式 .
请根据上述反应设计一个原电池,在方框中画出简易装置图(标出相应电极名称、电极材料、电解质溶液).
(2)写出图流程③相关反应的化学方程式: .
(3)如下图为相互串联的甲、乙两个电解池(A、B电极都是惰性电极)

请回答:
①写出两电解池中的电解反应方程式:
甲__________________________________________________
乙
②若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为______________。
③若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为____________。
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
【推荐1】为探究原电池和电解池的工作原理,某研究性小组分别用如图所示装置进行实验。

(1)甲装置中,a电极的反应式为_______________________________ 。
(2)乙装置中,阴极区产物为____________ 。
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为________ (填“正”或“负”)极,该装置内发生反应的化学方程式为________________ 、______________ 。
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为____________ (不考虑气体的溶解)。
(5)某工厂采用电解法处理含 Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为 Cr3+,Cr3+在阴极区生成 Cr(OH)3 沉淀除去,工作原理如图
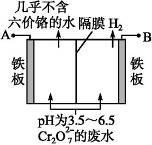
①写出电解时阴极的电极反应式______________________________ 。
②写出 Cr2O72-被还原为 Cr3+的离子方程式____________________________ 。

(1)甲装置中,a电极的反应式为
(2)乙装置中,阴极区产物为
(3)丙装置是一种家用环保型消毒液发生器。外接电源a为
(4)若甲装置作为乙装置的电源,一段时间后,甲中消耗气体与乙中产生气体的物质的量之比为
(5)某工厂采用电解法处理含 Cr2O72-的废水,耐酸电解槽用铁板作阴、阳极,槽内盛放含铬废水,Cr2O72-被还原成为 Cr3+,Cr3+在阴极区生成 Cr(OH)3 沉淀除去,工作原理如图

①写出电解时阴极的电极反应式
②写出 Cr2O72-被还原为 Cr3+的离子方程式
您最近一年使用:0次
填空题
|
较难
(0.4)
名校
解题方法
【推荐2】氮氧化物和硫氧化物的烟气处理关系到人们的身体健康,回答下列问题:
(1)NO用固态活性炭处理后可得到两种无污染的气体,请写出其化学方程式___________ 。
在压强为3.93MPa,200℃时,2L恒容密闭容器中加入0.10molNO和足量活性炭,达平衡时NO浓度为0.020mol/L,两种生成物均为0.030mol,则NO的转化率为___________ ,
___________ 。(保留小数点后两位)。
(2) 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为___________ ,熔融 中
中 向
向___________ 极移动(填石墨I或石墨II)。

(3)若烟气主要成分为 、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为
、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为___________ ,阳极的电极反应式为___________ 。

(4)用间接电化学法去除烟气中NO的原理如图所示。

已知阴极室溶液呈酸性,则阴极的电极反应式为___________ 。反应过程中通过质子交换膜的 为2mol时,吸收塔中生成的气体在标准状况下的体积为
为2mol时,吸收塔中生成的气体在标准状况下的体积为___________ L。
(1)NO用固态活性炭处理后可得到两种无污染的气体,请写出其化学方程式
在压强为3.93MPa,200℃时,2L恒容密闭容器中加入0.10molNO和足量活性炭,达平衡时NO浓度为0.020mol/L,两种生成物均为0.030mol,则NO的转化率为

(2)
 、
、 和熔融
和熔融 可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为
可制作燃料电池,其原理如图所示。该电池在放电过程中石墨I电极上生成氧化物Y,Y可循环使用,则Y为 中
中 向
向
(3)若烟气主要成分为
 、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为
、NO,可通过电解法除去,其原理如图所示。阴极的还原产物为
(4)用间接电化学法去除烟气中NO的原理如图所示。

已知阴极室溶液呈酸性,则阴极的电极反应式为
 为2mol时,吸收塔中生成的气体在标准状况下的体积为
为2mol时,吸收塔中生成的气体在标准状况下的体积为
您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐3】电化学知识给人类的生活和工业生产带来极大的方便。回答下列问题:
(1)碱性锌锰电池的总反应式为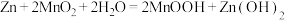 。负极材料为
。负极材料为___________ ,该电池正极反应式为___________ 。___________ 。
(3)用如图装置电解硫酸钾溶液,可获得H2、O2、硫酸和氢氧化钾溶液。X电极上发生的电极反应为___________ 。氢氧化钾溶液从___________ 口导出(填“A”或“D”),M、N交换膜中属于阳离子交换膜的是___________ (填“M”或“N”)。
(4)如图所示,若电解10min时,测得银电极的质量减少5.40g。试回答下列问题:___________ (填“正”或“负”)极。
②通电10min时,B中共收集到392mL(标准状况)气体,溶液体积为200mL(电解前后溶液的体积变化忽略不计),则通电前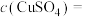
___________ mol/L,如果电解后要使该电解液复原,可以加入物质的化学式为___________ 。
(1)碱性锌锰电池的总反应式为
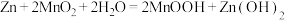 。负极材料为
。负极材料为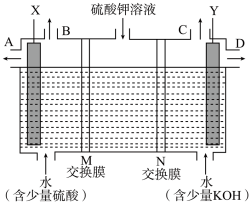
(3)用如图装置电解硫酸钾溶液,可获得H2、O2、硫酸和氢氧化钾溶液。X电极上发生的电极反应为
(4)如图所示,若电解10min时,测得银电极的质量减少5.40g。试回答下列问题:
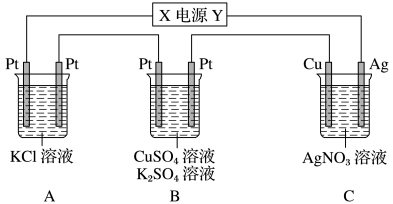
②通电10min时,B中共收集到392mL(标准状况)气体,溶液体积为200mL(电解前后溶液的体积变化忽略不计),则通电前
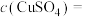
您最近一年使用:0次



