氯气可用于制取漂白剂和自来水消毒。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是_____ 。
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中。反应的离子方程式为_____ 。
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
已知,溶液中Cl2、HClO和ClO-占含氯元素微粒总数分数(α%)随溶液pH变化的关系如下图所示:
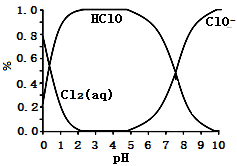

①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色_____ 。
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是_____ 。
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为_____ 。
(1)将氯气通入水中制得氯水,氯水可用于漂白,其中起漂白作用的物质是
(2)“84”消毒液也可用于漂白,其工业制法是控制在常温条件下,将氯气通入NaOH溶液中。反应的离子方程式为
(3)同学们探究“84”消毒液在不同pH下使红纸褪色的情况,做了如下实验:
步骤1:将5mL市售“84”消毒液稀释100倍,测得稀释后溶液的pH=12;
步骤2:将稀释后溶液各20mL分别加入3个洁净的小烧杯中;
步骤3:用H2SO4溶液将3个烧杯内溶液的pH分别调至10、7和4.(溶液体积变化忽略不计)
步骤4:在3个烧杯中分别放入大小相同的红纸,观察现象,记录如下:
| 烧杯 | 溶液的pH | 现象 |
| a | 10 | 10min后,红纸基本不褪色;4h后红纸褪色 |
| b | 7 | 10min后,红纸颜色变浅;4h后红纸褪色 |
| c | 4 | 10min后,红纸颜色变得更浅;4h后红纸褪色 |


①由实验现象可获得以下结论:溶液的pH在4~10范围内,pH越大,红纸褪色
②结合图像进行分析,b、c两烧杯中实验现象出现差异的原因是
(4)由于氯气会与自来水中的有机物发生反应生成对人体有害的物质,人们尝试研究并使用新的自来水消毒剂,如ClO2气体就是一种新型高效含氯消毒剂。一种制备ClO2的方法是用SO2通入硫酸酸化的NaClO3溶液中,反应的离子方程式为
更新时间:2024-01-07 11:48:47
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】一场突如其来的新冠肺炎疫情,给人们的生活带来了巨大的冲击,在疫情期间外出需戴好口罩,返家后立即杀菌消毒。含氯消毒剂在日常生产生活中有着广泛的用途。
(1)实验室除了可以用 和浓盐酸制氯气外,还可以利用如下反应制取氯气:
和浓盐酸制氯气外,还可以利用如下反应制取氯气: 。若要制取标准状况下3.36L氯气,则发生反应的HCl的质量为
。若要制取标准状况下3.36L氯气,则发生反应的HCl的质量为_______ g,其中被氧化的HCl的物质的量为_______ mol,反应过程中转移的电子数为_______  。
。
(2)“84”消毒液(有效成分为NaClO)在抗击新冠肺炎疫情战役中发挥了重要的作用。常温下,可利用氯气与烧碱溶液反应制得“84”消毒液,在使用前将“84”消毒液的稀释液放置在空气中一段时间,其漂白效果更好,原因为_______ (用离子方程式表示,已知通常情况下,弱酸不能制强酸,酸性: )。
)。
(3)二氧化氯( )是一种黄绿色的气体。可用作饮用水的消毒杀菌处理剂,是国际上公认的安全、低毒的绿色消毒剂。实验室可用
)是一种黄绿色的气体。可用作饮用水的消毒杀菌处理剂,是国际上公认的安全、低毒的绿色消毒剂。实验室可用 和浓盐酸在一定温度下反应制得:
和浓盐酸在一定温度下反应制得: 。
。
①该反应的氧化产物为_______ (填化学式)。
②在该反应中浓盐酸表现出来的性质是_______ (填标号)。
A.还原性 B.氧化性 C.酸性
③ 、
、 、
、 (还原产物为
(还原产物为 )、
)、 等物质常被用作消毒剂。等物质的量的上述物质消毒的效率(以1mol物质的得电子数来衡量)最高的是
等物质常被用作消毒剂。等物质的量的上述物质消毒的效率(以1mol物质的得电子数来衡量)最高的是_______ (填标号)。
A. B.
B.  C.
C. D.
D.
(1)实验室除了可以用
 和浓盐酸制氯气外,还可以利用如下反应制取氯气:
和浓盐酸制氯气外,还可以利用如下反应制取氯气: 。若要制取标准状况下3.36L氯气,则发生反应的HCl的质量为
。若要制取标准状况下3.36L氯气,则发生反应的HCl的质量为 。
。(2)“84”消毒液(有效成分为NaClO)在抗击新冠肺炎疫情战役中发挥了重要的作用。常温下,可利用氯气与烧碱溶液反应制得“84”消毒液,在使用前将“84”消毒液的稀释液放置在空气中一段时间,其漂白效果更好,原因为
 )。
)。(3)二氧化氯(
 )是一种黄绿色的气体。可用作饮用水的消毒杀菌处理剂,是国际上公认的安全、低毒的绿色消毒剂。实验室可用
)是一种黄绿色的气体。可用作饮用水的消毒杀菌处理剂,是国际上公认的安全、低毒的绿色消毒剂。实验室可用 和浓盐酸在一定温度下反应制得:
和浓盐酸在一定温度下反应制得: 。
。①该反应的氧化产物为
②在该反应中浓盐酸表现出来的性质是
A.还原性 B.氧化性 C.酸性
③
 、
、 、
、 (还原产物为
(还原产物为 )、
)、 等物质常被用作消毒剂。等物质的量的上述物质消毒的效率(以1mol物质的得电子数来衡量)最高的是
等物质常被用作消毒剂。等物质的量的上述物质消毒的效率(以1mol物质的得电子数来衡量)最高的是A.
 B.
B.  C.
C. D.
D.
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】工业上用 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
(1) Ca(ClO)2中Cl元素的化合价是___________ ;工业上将氯气制成漂白粉的主要目的是___________ 。工业上制成漂白粉的化学方程式:___________ 。
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
(3)浸泡衣物时加入漂粉精(有效成分Ca(ClO)2)在空气中放置一段时间漂白效果更好,请用化学方程式解释原因:___________ 。
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是___________ 。
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②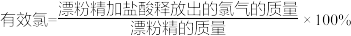 。
。
若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为___________ (计算结果保留一位小数)。
 和碱制漂白粉、漂粉精及漂白液。请回答下列问题:
和碱制漂白粉、漂粉精及漂白液。请回答下列问题:(1) Ca(ClO)2中Cl元素的化合价是
(2)下列物质露置在空气中会变质,在变质过程中既有非氧化还原反应发生,又有氧化还原反应发生的是___________(填字母)。
| A.生石灰 | B.漂白粉 |
| C.NaOH | D. |
(4)若将漂白液(有效成分NaClO)与洁厕灵(主要成分是盐酸)混合使用,则会产生有毒气体,其反应的离子方程式是
(5)有效氯是漂白粉中有效成分Ca(ClO)2含量大小的标志。
已知:①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②
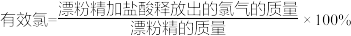 。
。若某漂粉精的有效氯为60%,该漂粉精中Ca(ClO)2的质量分数为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】请用学过的知识分析其中的化学原理并写出化学方程式,属于离子反应的请写出离子方程式。
(1)将氯气通入熟石灰即可制的漂白粉【漂白粉的有效成分是次氯酸钙Ca(ClO)2,商品漂白粉往往含有Ca(OH)2等杂质】_________________________________ 。
(2)漂白粉之所以具有漂白作用是由于Ca(ClO)2在水溶液中发生水解反应生成具有强氧化性的物质__________________________ 。
(3)Ca(OH)2杂质的存在使溶液的碱性增强,因此漂白作用进行缓慢。要在短时间受到漂白效果,必须除去Ca(OH)2,所以工业上使用漂白粉是常加入少量弱酸如醋酸等,或加入少量的稀盐酸____________________ 、__________________ 。
(4)家庭使用漂白粉不必加酸,因为水中的CO2也起到了弱酸的作用_______________ 。
(5)不要将漂白粉与洁厕剂等强酸性物质混合使用,因为在强酸性条件下二者可以发生氧化还原反应生成一种有毒气体:_____________
(1)将氯气通入熟石灰即可制的漂白粉【漂白粉的有效成分是次氯酸钙Ca(ClO)2,商品漂白粉往往含有Ca(OH)2等杂质】
(2)漂白粉之所以具有漂白作用是由于Ca(ClO)2在水溶液中发生水解反应生成具有强氧化性的物质
(3)Ca(OH)2杂质的存在使溶液的碱性增强,因此漂白作用进行缓慢。要在短时间受到漂白效果,必须除去Ca(OH)2,所以工业上使用漂白粉是常加入少量弱酸如醋酸等,或加入少量的稀盐酸
(4)家庭使用漂白粉不必加酸,因为水中的CO2也起到了弱酸的作用
(5)不要将漂白粉与洁厕剂等强酸性物质混合使用,因为在强酸性条件下二者可以发生氧化还原反应生成一种有毒气体:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐1】新型冠状病毒蔓延期间,为做好自我保护,我们要减少外出,避免与表现出有呼吸道疾病症状的人密切接触,外出最重要的防护措施是佩戴符合要求的口罩。在生活中常见的口罩一般有棉布口罩、医用外科口罩、活性炭口罩和N95口罩。也可以在实验室进行制备84消毒液(有效成分是NaClO)。
(1)新型冠状病毒可以通过气溶胶传播,气溶胶属于分散系中的___________ (“溶液”、“胶体”、“悬浊液”)。
(2)佩戴口罩预防疾病的原理相当于化学实验中的_________ 操作。(“蒸发”、“过滤”“萃取”)
(3)生成N95口罩的主要原料是聚丙烯,它属于___________ (填“金属材料”或“合成材料”)
(4)如图是模拟84消毒液的装置,实验室先制备氯气,再通入氢氧化钠溶液,写出发生的化学反应方程式:__________________________ ,氧化剂是_________ ,氧化产物是_________ 。
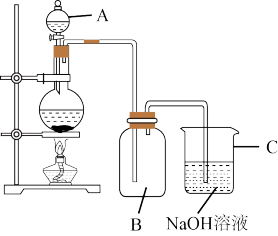
(5)84消毒液和洁厕灵混合使用时会发生化学反应2HCl+NaClO=NaCl+H2O+X↑,使消毒液失效,杀菌消毒能力减弱,易发生生命危险,X为_________ 。
(1)新型冠状病毒可以通过气溶胶传播,气溶胶属于分散系中的
(2)佩戴口罩预防疾病的原理相当于化学实验中的
(3)生成N95口罩的主要原料是聚丙烯,它属于
(4)如图是模拟84消毒液的装置,实验室先制备氯气,再通入氢氧化钠溶液,写出发生的化学反应方程式:

(5)84消毒液和洁厕灵混合使用时会发生化学反应2HCl+NaClO=NaCl+H2O+X↑,使消毒液失效,杀菌消毒能力减弱,易发生生命危险,X为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】除去下列物质中混有的少量杂质,用有关反应的离子方程式表示:
(1)Fe2O3中混有Al2O3:___________________________________
(2)Na2CO3溶液中混有NaHCO3:__________________________
(3)FeCl2溶液中混有FeCl3:______________________________
(4)“84”消毒液是生活中常用的含氯消毒剂,其制备过程的主要反应是将氯气通入氢氧化钠溶液中,反应的化学方程式为________________________________________
(1)Fe2O3中混有Al2O3:
(2)Na2CO3溶液中混有NaHCO3:
(3)FeCl2溶液中混有FeCl3:
(4)“84”消毒液是生活中常用的含氯消毒剂,其制备过程的主要反应是将氯气通入氢氧化钠溶液中,反应的化学方程式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。
(1)阅读资料,回答下列相关问题。

①资料涉及的物质中,属于碱的是____ (填化学式);属于盐的是____ (填化学式)。
②Cl2与NaOH溶液反应的离子方程式是____ 。
③“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,其中发生的化学反应符合规律: + = + (填物质类别 )____ 。
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。
①该反应中起氧化作用的微粒是____ 。。
②若反应中生成了0.01molCl2,转移电子的物质的量为____ mol。
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO____ H2O2的(填“>”或“<”)。
(1)阅读资料,回答下列相关问题。

①资料涉及的物质中,属于碱的是
②Cl2与NaOH溶液反应的离子方程式是
③“84”消毒液的稀溶液在浸泡餐具过程中,因吸收空气中CO2使消毒杀菌能力增强,其中发生的化学反应符合规律: + = + (
(2)“84”消毒液不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。
①该反应中起氧化作用的微粒是
②若反应中生成了0.01molCl2,转移电子的物质的量为
(3)2016年巴西奥运会期间,由于工作人员将“84”消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO
您最近一年使用:0次



