如图所示是铁及其化合物的“价类”二维图:

(1)X、Y分别代表_________ 、__________ ;(各1分)Z在空气中转化为W的化学方程式为__________ ,现象_________________________
(2)某小组研究 性质,预测
性质,预测 能与
能与___________ 发生氧化还原反应(填序号)
① 溶液 ②氯水 ③稀盐酸 ④酸性
溶液 ②氯水 ③稀盐酸 ④酸性 溶液 ⑤
溶液 ⑤ 溶液 ⑥碳酸钠
溶液 ⑥碳酸钠
(3)铁盐溶液可用于金属刻蚀,如何检验某溶液中存在
_________________________________ (写出两种检验手段);如用 溶液刻蚀铜制电路板,
溶液刻蚀铜制电路板, 被
被_________ (填“还原”或“氧化”)为 ,该反应的离子方程式为
,该反应的离子方程式为_____________________________ 。

(1)X、Y分别代表
(2)某小组研究
 性质,预测
性质,预测 能与
能与①
 溶液 ②氯水 ③稀盐酸 ④酸性
溶液 ②氯水 ③稀盐酸 ④酸性 溶液 ⑤
溶液 ⑤ 溶液 ⑥碳酸钠
溶液 ⑥碳酸钠(3)铁盐溶液可用于金属刻蚀,如何检验某溶液中存在

 溶液刻蚀铜制电路板,
溶液刻蚀铜制电路板, 被
被 ,该反应的离子方程式为
,该反应的离子方程式为
更新时间:2024-01-09 07:08:38
|
相似题推荐
填空题
|
适中
(0.65)
【推荐1】回答下列问题:
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。相互间能发生反应的是___________ 。(填序号)
(2)检验Na2O2其组成中所含阳离子的方法是___________ 。
(3)FeSO4·7H2O俗称绿矾,在医药工业中可用于补铁剂的制造,而硫酸亚铁溶液在保存时需要加入适量的铁粉,请用离子方程式简述其原因___________ 。
(4)铝合金具有广泛的用途,但铝制器具不宜盛放碱性食物,其请写出该反应的离子方程式___________ ,若生成6.72L气体(标准状况),则消耗铝的质量为___________ g。
(1)厨房中的调味品,①盐(主要成分氯化钠)、②碱面(主要成分碳酸钠)、③白醋(主要成分乙酸)。相互间能发生反应的是
(2)检验Na2O2其组成中所含阳离子的方法是
(3)FeSO4·7H2O俗称绿矾,在医药工业中可用于补铁剂的制造,而硫酸亚铁溶液在保存时需要加入适量的铁粉,请用离子方程式简述其原因
(4)铝合金具有广泛的用途,但铝制器具不宜盛放碱性食物,其请写出该反应的离子方程式
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】长期放置的FeSO4溶液易被氧化而变质,某兴趣小组进行了如下实验:
(1)设计实验检验FeSO4溶液的变质程度
①将上述方案补充完整。
②若要使部分变质的FeSO4复原,方法是___________ (写离子反应方程式) 。
(2)利用部分变质的FeSO4溶液制备Fe2O3

①请在( )内填写所需试剂或条件___________ 、___________ 、___________ ,在□内填写含铁物质的化学式___________ 、___________ (以离子形式存在的可写离子符号)。
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的物质的量浓度为___________ 。
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
由上述实验能否得出“维生素C可将Fe3+转化为Fe2+”的结论?请说明理由___________ 。
(1)设计实验检验FeSO4溶液的变质程度
| 实验方案 | 实验现象 | 离子方程式 | 实验结论 | |
| 步骤1 | 取待检测液于试管中,向其中滴加KSCN溶液 | FeSO4溶液部分变质 | ||
| 步骤2 | ||||
②若要使部分变质的FeSO4复原,方法是
(2)利用部分变质的FeSO4溶液制备Fe2O3

①请在( )内填写所需试剂或条件
②若100mL该变质溶液制得1.6gFe2O3,则变质前FeSO4溶液的物质的量浓度为
(3)FeSO4可用作补铁剂,使用时建议与维生素C同服,同学甲猜测维生素C可将Fe3+转化为Fe2+,以利于人体吸收。为了验证这一猜想,设计了如下实验:
| 实验方案 | 实验现象 |
| 取适量 Fe2(SO4)3溶液于试管中,加入维生素C片,振荡溶解后,滴加酸性高锰酸钾溶液。 | 紫色褪去 |
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】Ⅰ.“价类”二维图是学习元素及其化合物的重要工具.如图所示是铁及其化合物的“价类”二维图。__________ 、__________ ;Z在空气中转化为W的化学方程式为__________ 。
(2)含重铬酸根离子 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
______ (填“>”或“<”) 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为__________ g。
Ⅱ.硫酸亚铁晶体 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加__________ 后,溶液变为红色,证实了怀疑。
(4)步骤②反应的离子方程式为__________ ,下列物质中可以用来代替该步骤中的 是
是__________ (填序号)。
① 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠
(5)服用维生素C可使食物中的 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的__________ 性。假设实验中的损耗忽略不计,则该补血剂含铁元素的质量分数为__________ 。

(2)含重铬酸根离子
 的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾
的工业废水有毒,必须经过处理达标后才能排放。工业上常用绿矾 作处理剂,发生反应的离子方程式为
作处理剂,发生反应的离子方程式为 ,则该反应中还原性:
,则该反应中还原性:
 。该反应中,每生成
。该反应中,每生成 ,消耗
,消耗 的质量为
的质量为Ⅱ.硫酸亚铁晶体
 在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为
在医药上作补血剂。某课外小组取10片补血剂总质量w g,通过一系列反应转变为 来测定该补血剂中铁元素的含量。实验步骤如下:
来测定该补血剂中铁元素的含量。实验步骤如下:
(3)某同学发现部分补血剂药片表面发黄,怀疑该补铁剂已经变质,遂取少量步骤①的滤液,滴加
(4)步骤②反应的离子方程式为
 是
是①
 溶液 ②氯水 ③稀盐酸 ④碳酸钠
溶液 ②氯水 ③稀盐酸 ④碳酸钠(5)服用维生素C可使食物中的
 转化为
转化为 ,从而实现科学补铁,在这个过程中体现出维生素C的
,从而实现科学补铁,在这个过程中体现出维生素C的
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】完成下列问题
(1)用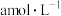 的盐酸滴定未知浓度的
的盐酸滴定未知浓度的 溶液,用酚酞作指示剂,达到滴定终点的现象是
溶液,用酚酞作指示剂,达到滴定终点的现象是_______ ;若用甲基橙作指示剂,滴定终点现象是_______ 。
(2)用标准碘溶液滴定溶有 的水溶液,以测定水中
的水溶液,以测定水中 的含量,应选用
的含量,应选用_______ 作指示剂,达到滴定终点的现象是_______ 。
(3)用标准酸性 溶液滴定溶有
溶液滴定溶有 的水溶液,以测定水中
的水溶液,以测定水中 的含量,是否需要选用指示剂
的含量,是否需要选用指示剂_______ (填“是”或“否”),达到滴定终点的现象是_______ 。
(4)用氧化还原滴定法测定 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再用
,再用 溶液作指示剂,用
溶液作指示剂,用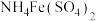 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 ,滴定
,滴定 时发生反应的离子方程式为
时发生反应的离子方程式为_______ ,达到滴定终点的现象是_______ 。
(5)用标准 溶液滴定含有
溶液滴定含有 的溶液,应选用
的溶液,应选用_______ 作指示剂,滴定终点现象是_______ 。
(1)用
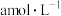 的盐酸滴定未知浓度的
的盐酸滴定未知浓度的 溶液,用酚酞作指示剂,达到滴定终点的现象是
溶液,用酚酞作指示剂,达到滴定终点的现象是(2)用标准碘溶液滴定溶有
 的水溶液,以测定水中
的水溶液,以测定水中 的含量,应选用
的含量,应选用(3)用标准酸性
 溶液滴定溶有
溶液滴定溶有 的水溶液,以测定水中
的水溶液,以测定水中 的含量,是否需要选用指示剂
的含量,是否需要选用指示剂(4)用氧化还原滴定法测定
 的质量分数:一定条件下,将
的质量分数:一定条件下,将 溶解并还原为
溶解并还原为 ,再用
,再用 溶液作指示剂,用
溶液作指示剂,用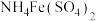 标准溶液滴定
标准溶液滴定 至全部生成
至全部生成 ,滴定
,滴定 时发生反应的离子方程式为
时发生反应的离子方程式为(5)用标准
 溶液滴定含有
溶液滴定含有 的溶液,应选用
的溶液,应选用
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】久置的FeSO4溶液变黄,一般认为是Fe2+被氧化的缘故。回答下列问题:
(1)久置的FeSO4溶液中Fe3+的检验:向久置的FeSO4溶液中加入KSCN的现象为:______________________________
(2)除去久置FeSO4溶液中Fe3+:在溶液中加入足量铁粉,可以观察到的现象为:______________________ ;反应的离子方程式为:____________________________
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。写出Fe(OH)2在空气中被氧化的现象为_________________________ 写出化学方程式,并用双线桥标注电子转移:________________________________
(1)久置的FeSO4溶液中Fe3+的检验:向久置的FeSO4溶液中加入KSCN的现象为:
(2)除去久置FeSO4溶液中Fe3+:在溶液中加入足量铁粉,可以观察到的现象为:
(3)查阅资料:溶液中Fe2+的氧化过程分为两步,首先是Fe2+水解为Fe(OH)2,接着水解产物被O2氧化。写出Fe(OH)2在空气中被氧化的现象为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】某学习小组欲确定某混合溶液中是否含有以下离子Al3+、Fe3+、Cl-、Na+,采取如下方法,请回答问题:
(1)取少量溶液于试管中,滴加KSCN溶液,溶液变为红色,说明溶液中存在______ ,向该溶液中加入铁粉,写出发生反应的离子方程式___________________ 。
(2)另取少量溶液于试管中,逐滴滴加NaOH溶液,实验发现产生的沉淀先增加后略有减少,说明溶液中存在_________ ,写出沉淀减少的化学方程式___________ 。
(3)请用简要的文字,结合离子方程式说明检验Cl-的实验方法____________________ ,离子方程式为______________ 。
(4)在焰色反应实验中,若观察到火焰的颜色为黄色,则证明该溶液中存在__________ 。
(1)取少量溶液于试管中,滴加KSCN溶液,溶液变为红色,说明溶液中存在
(2)另取少量溶液于试管中,逐滴滴加NaOH溶液,实验发现产生的沉淀先增加后略有减少,说明溶液中存在
(3)请用简要的文字,结合离子方程式说明检验Cl-的实验方法
(4)在焰色反应实验中,若观察到火焰的颜色为黄色,则证明该溶液中存在
您最近一年使用:0次



