常温下,用0.1000mol•L﹣1 NaOH溶液滴定20.00mL 0.1000mol•L﹣1 CH3COOH溶液所得滴定曲线如图,下列说法不正确的是
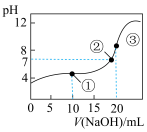

| A.点③溶液显碱性的原因是CH3COO﹣+H2O=CH3COOH+OH﹣ |
| B.点②时溶液中c(Na+)大于c(CH3COO﹣) |
| C.点①溶液中 c(CH3COOH)+c(H+)>c(CH3COO﹣)+c(OH﹣) |
| D.在逐滴加入NaOH溶液至40mL的过程中,水的电离程度先增大后减小 |
更新时间:2024-01-20 21:41:46
|
【知识点】 酸碱中和滴定的综合考查解读
相似题推荐
多选题
|
较易
(0.85)
解题方法
【推荐1】下列实验操作、现象和结论都正确的是
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向含甲基橙的 溶液中滴加 溶液中滴加 稀溶液 稀溶液 | 橙色刚好变为黄色 |  |
| B | 向乙酸乙酯中滴加溶液R | 溶液不分层 | 溶液R可能是 溶液 溶液 |
| C | 向酸性 溶液中滴入乙醇 溶液中滴入乙醇 | 溶液由紫红色变为无色 | 乙醇具有还原性 |
| D | 在铝片上滴加 溶液 溶液 | 无明显现象 | 铝不和 反应 反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
多选题
|
较易
(0.85)
解题方法
【推荐2】准确移取20.00mL某待测醋酸于锥形瓶中,用0.1000mol·L-1NaOH标准溶液滴定。下列说法错误的是( )
| A.滴定管用蒸馏水洗涤后,先用NaOH标准溶液润洗再装入NaOH标准溶液 |
| B.随着NaOH标准溶液的滴入,混合溶液的电导率逐渐增大 |
| C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时,立即停止滴定,读取数据 |
| D.若滴定过程中发现已过滴定终点,则实验失败,必须重新进行实验 |
您最近一年使用:0次
多选题
|
较易
(0.85)
名校
解题方法
【推荐3】常温下,用0.10 mol·L-1 NaOH溶液分别滴定20.00 mL 0.10 mol·L-1 HCl溶液和20.00 mL 0.10 mol·L-1 CH3COOH溶液,得到两条滴定曲线,如图所示,则下列说法不正确的是( )


| A.图1是滴定盐酸的曲线 |
| B.a与b的关系是a>b |
| C.E点对应离子浓度由大到小的顺序可能为c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| D.水的电离程度B>D |
您最近一年使用:0次



