回答下列问题
(1)危化品仓库的金属钠着火不能用水浇灭,可以用___________ 灭火。
(2)碳酸氢钠( )是一种重要的化工原料,1791年,法国化学家尼古拉斯·勒布朗(Nicolas Leblanc)制备出碳酸钠(
)是一种重要的化工原料,1791年,法国化学家尼古拉斯·勒布朗(Nicolas Leblanc)制备出碳酸钠( ),为碳酸氢钠的合成奠定了基础。写出一种利用
),为碳酸氢钠的合成奠定了基础。写出一种利用化合反应 制备 的化学反应方程式
的化学反应方程式___________ 。
(3)写出实验室制备氯气的离子方程式:___________ 。
(4)氢氧化亚铁为白色絮状沉淀,但在空气中迅速变成灰绿色,最后变成红褐色,试用化学反应方程式说明变色原理:___________ 。
(1)危化品仓库的金属钠着火不能用水浇灭,可以用
(2)碳酸氢钠(
 )是一种重要的化工原料,1791年,法国化学家尼古拉斯·勒布朗(Nicolas Leblanc)制备出碳酸钠(
)是一种重要的化工原料,1791年,法国化学家尼古拉斯·勒布朗(Nicolas Leblanc)制备出碳酸钠( ),为碳酸氢钠的合成奠定了基础。写出一种利用
),为碳酸氢钠的合成奠定了基础。写出一种利用 的化学反应方程式
的化学反应方程式(3)写出实验室制备氯气的离子方程式:
(4)氢氧化亚铁为白色絮状沉淀,但在空气中迅速变成灰绿色,最后变成红褐色,试用化学反应方程式说明变色原理:
更新时间:2024/01/27 21:18:26
|
相似题推荐
填空题
|
较易
(0.85)
名校
【推荐1】科学家舍勒和戴维对氯气的制取和研究做出了重大贡献。某兴趣小组利用所给仪器在实验室制备纯净干燥的氯气,并模拟工业制漂白粉。请回答下列问题:
Ⅰ.实验室制备和收集氯气的常用装置如下图。
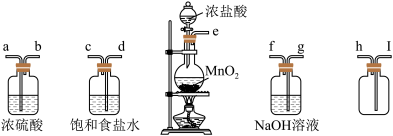
(1)利用该装置制备氯气的化学方程式为_______ 。
(2)在实验过程中饱和食盐水的作用是_______ 。
(3)实验装置接口的连接顺序为e→_______→_______→_______→_______→i→h→g→f。_______
(4)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中HCl的作用是还原性和_______ ,若反应产生0.5molCl2,则反应转移的电子数是_______ 。
II.漂白粉的制备( 装置如图所示)
查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2 CaCl2+Ca(ClO3)2+6H2O。
CaCl2+Ca(ClO3)2+6H2O。

(5)装置C中发生反应的化学方程式为_______ 。
(6)多孔球泡的作用是_______ ,使用冰水浴的目的是_______ 。
Ⅰ.实验室制备和收集氯气的常用装置如下图。

(1)利用该装置制备氯气的化学方程式为
(2)在实验过程中饱和食盐水的作用是
(3)实验装置接口的连接顺序为e→_______→_______→_______→_______→i→h→g→f。
(4)实验室除了可用二氧化锰和浓盐酸反应制取氯气外,还可以用其他很多方法制取氯气,其中用高锰酸钾和浓盐酸反应制备氯气的化学方程式可表示为:2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,该反应中HCl的作用是还原性和
II.漂白粉的制备( 装置如图所示)
查阅资料可知:①氯气与碱反应放出热量;
②6Cl2+6Ca(OH)2
 CaCl2+Ca(ClO3)2+6H2O。
CaCl2+Ca(ClO3)2+6H2O。
(5)装置C中发生反应的化学方程式为
(6)多孔球泡的作用是
您最近一年使用:0次
填空题
|
较易
(0.85)
【推荐2】I.图为含氯元素物质的“价类二维图”,请结合该图和所学知识完成下列问题。
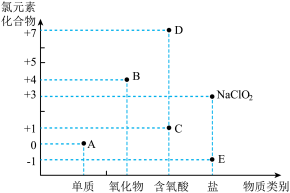
(1)D的电离方程式为_______
(2)A、B和 均可作为消毒剂。
均可作为消毒剂。
① 的消毒效率是A的
的消毒效率是A的_______ 倍(还原产物都是E,消毒效率以单位物质的量的物质得到的电子数表示)。
②B在杀菌消毒过程中会产生 ,需将
,需将 转化为E除去,下列试剂可实现转化的是
转化为E除去,下列试剂可实现转化的是_______ (填标号)。
a. b.
b. c.
c. d.
d.
(3)将 传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
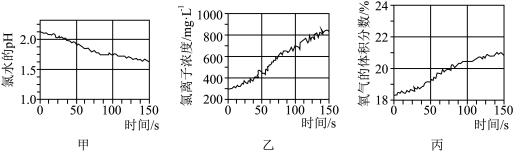
由图可推知,光照时发生的反应为_______ (写出化学方程式)。
II.实验室制取A并进一步制取无水 的实验装置如图所示。
的实验装置如图所示。
已知:无水 在空气中易与水发生作用,加热易升华。
在空气中易与水发生作用,加热易升华。
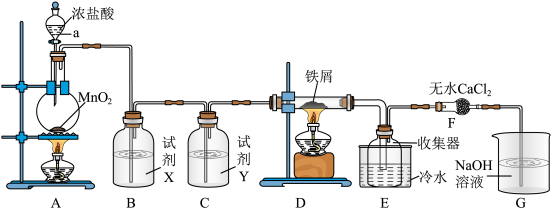
回答下列问题:
(4)仪器a的名称是_______ ,装置A所发生的氧化还原反应中,氧化剂与还原剂的物质的量之比为_______ 。
(5)试剂X、试剂Y依次是_______ 、_______ 。
(6)装置F中无水 的作用是
的作用是_______
(7)某温度下,将氯气通入G装置中,反应得到 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:_______ 。

(1)D的电离方程式为
(2)A、B和
 均可作为消毒剂。
均可作为消毒剂。①
 的消毒效率是A的
的消毒效率是A的②B在杀菌消毒过程中会产生
 ,需将
,需将 转化为E除去,下列试剂可实现转化的是
转化为E除去,下列试剂可实现转化的是a.
 b.
b. c.
c. d.
d.
(3)将
 传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
传感器、氯离子传感器、氧气传感器分别插入盛有A的水溶液的广口瓶中,用强光照射,测得的实验数据如图所示。
由图可推知,光照时发生的反应为
II.实验室制取A并进一步制取无水
 的实验装置如图所示。
的实验装置如图所示。已知:无水
 在空气中易与水发生作用,加热易升华。
在空气中易与水发生作用,加热易升华。
回答下列问题:
(4)仪器a的名称是
(5)试剂X、试剂Y依次是
(6)装置F中无水
 的作用是
的作用是(7)某温度下,将氯气通入G装置中,反应得到
 ,
, 和
和 的混合溶液,经测定
的混合溶液,经测定 与
与 的物质的量之比为4∶1,写出该反应总的离子方程式:
的物质的量之比为4∶1,写出该反应总的离子方程式:
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】请正确回答下列问题
(1)写出纯碱的化学式:_______ ;漂白粉的有效成分是_______ ;
(2)小苏打在溶液中的电离方程式_______ ;实验室制氯气的离子方程式_______ 。
(3)现有以下物质: ①NaCl晶体②盐酸③CaCO3固体④熔融KCl⑤蔗糖⑥铜⑦CO2,以上物质中能导电的是_______ (填写序号,下同);以上物质中属于电解质的是_______ 。
(4)用单线桥法标出以下反应的电子转移方向和数目:__________
TiO2+2C+2Cl2= TiCl4+2CO
(1)写出纯碱的化学式:
(2)小苏打在溶液中的电离方程式
(3)现有以下物质: ①NaCl晶体②盐酸③CaCO3固体④熔融KCl⑤蔗糖⑥铜⑦CO2,以上物质中能导电的是
(4)用单线桥法标出以下反应的电子转移方向和数目:
TiO2+2C+2Cl2= TiCl4+2CO
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐1】化学是一门实用性很强的科学,请根据题意用化学式填空:
(1)钠有多种化合物,其中俗称“纯碱”的是___________
(2)铁有多种氧化物,其中为黑色且具有磁性的是___________
(3)日常生活中,活泼的铝在空气中能稳定存在的原因是表层的铝在空气中反应生成了___________ 保护内层金属
(4)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用。已知“84”消毒液的制备原理为___________ (填写化学方程式);其在使用前须在空气中放置一段时间的原因是___________ (用离子方程式表示)
(1)钠有多种化合物,其中俗称“纯碱”的是
(2)铁有多种氧化物,其中为黑色且具有磁性的是
(3)日常生活中,活泼的铝在空气中能稳定存在的原因是表层的铝在空气中反应生成了
(4)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用。已知“84”消毒液的制备原理为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐2】按要求回答下列问题
(1)侯氏制碱法制得的“碱”的化学式:____ ,磁性氧化铁的化学式:____ 。
(2)漂白粉的有效成分化学式是____ ;胶体的本质特征:____ 。
(3)用化学方程式表示炽热的铁水不能注入潮湿的模具中的原因:____ 。
(4)用离子方程式表示打磨过的铝片遇NaOH溶液产生气泡的原因:____ 。
(1)侯氏制碱法制得的“碱”的化学式:
(2)漂白粉的有效成分化学式是
(3)用化学方程式表示炽热的铁水不能注入潮湿的模具中的原因:
(4)用离子方程式表示打磨过的铝片遇NaOH溶液产生气泡的原因:
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐3】碳酸钠和碳酸氢钠是生活中常见的物质。
回答下列问题:
(1)向碳酸钠饱和溶液中通入 溶液变浑浊,反应的离子方程式为
溶液变浑浊,反应的离子方程式为___________ ;由此可知在相同温度下,碳酸钠的溶解度比碳酸氢钠的___________ (填“大”或“小”)。
(2)碳酸氢钠溶液与氢氧化钙溶液按溶质的物质的量之比为2∶1混合反应时,所得溶液中溶质为___________ (写化学式);检验所得溶液中溶质的阴离子的方法是___________ 。
(3)将27.4g 和
和 的混合物,加热到质量不再变化时,得残留固体21.2g.则原混合物中
的混合物,加热到质量不再变化时,得残留固体21.2g.则原混合物中 和
和 的质量之比为
的质量之比为___________ 。
(4)向碳酸钠溶液中逐滴滴入稀盐酸的微观示意图如下。由图可知向碳酸钠溶液中逐滴滴入稀盐酸时,实质是 依次与
依次与___________ 、___________ 发生反应(填微粒符号)。

回答下列问题:
(1)向碳酸钠饱和溶液中通入
 溶液变浑浊,反应的离子方程式为
溶液变浑浊,反应的离子方程式为(2)碳酸氢钠溶液与氢氧化钙溶液按溶质的物质的量之比为2∶1混合反应时,所得溶液中溶质为
(3)将27.4g
 和
和 的混合物,加热到质量不再变化时,得残留固体21.2g.则原混合物中
的混合物,加热到质量不再变化时,得残留固体21.2g.则原混合物中 和
和 的质量之比为
的质量之比为(4)向碳酸钠溶液中逐滴滴入稀盐酸的微观示意图如下。由图可知向碳酸钠溶液中逐滴滴入稀盐酸时,实质是
 依次与
依次与
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
解题方法
【推荐1】回答下列问题:
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为____ ,反应后得到的溶液呈____ 色。用此溶液进行以下实验:
(2)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为_____ 。
(3)另取少量原溶液于试管中,滴入KSCN溶液,则溶液呈____ 色,离子方程式为____ 。
(4)另取少量原溶液于试管中加入足量的铁粉,溶液变为浅绿色,取浅绿色溶液于试管中,加入NaOH溶液得到白色沉淀,露置在空气中所观察到的现象为____ ,产生该现象的化学方程式为____ 。
(1)取少量Fe2O3粉末(红棕色)加入适量盐酸,所发生反应的化学方程式为
(2)取少量溶液置于试管中,滴入NaOH溶液,可观察到有红褐色沉淀生成,反应的离子方程式为
(3)另取少量原溶液于试管中,滴入KSCN溶液,则溶液呈
(4)另取少量原溶液于试管中加入足量的铁粉,溶液变为浅绿色,取浅绿色溶液于试管中,加入NaOH溶液得到白色沉淀,露置在空气中所观察到的现象为
您最近一年使用:0次
填空题
|
较易
(0.85)
名校
【推荐2】I.完成以下方程式:⑴写离子方程式,⑵⑶⑷写化学方程式
⑴Na与H2O:________________ ;
⑵氢氧化亚铁露置在空气中:________________ ;
⑶制粗Si:________________ ;
⑷少量CO2通入Na2SiO3溶液:________________ 。
II.有以下物质:①Fe2O3②Na2CO3③Cl2④浓盐酸⑤浓硫酸⑥SO2⑦高岭石Al2(Si2O5)(OH)4
⑸属于碱性氧化物的是________________ (填序号);
⑹工业上用③与石灰乳制取漂白粉,漂白粉的有效成分的化学式是_____________ ;
⑺写出Cu与⑤反应的化学方程式________________ 。
⑻请将物质⑦改写成氧化物的形式________________ 。
⑴Na与H2O:
⑵氢氧化亚铁露置在空气中:
⑶制粗Si:
⑷少量CO2通入Na2SiO3溶液:
II.有以下物质:①Fe2O3②Na2CO3③Cl2④浓盐酸⑤浓硫酸⑥SO2⑦高岭石Al2(Si2O5)(OH)4
⑸属于碱性氧化物的是
⑹工业上用③与石灰乳制取漂白粉,漂白粉的有效成分的化学式是
⑺写出Cu与⑤反应的化学方程式
⑻请将物质⑦改写成氧化物的形式
您最近一年使用:0次
填空题
|
较易
(0.85)
解题方法
【推荐3】铁是应用最广泛的金属,铁的氯化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)在实验室中,FeCl2可用铁粉和___________ (填名称)反应制备。
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是___________ ,对应的化学方程式为___________ 。
(3)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:___________ 。
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:___________ 。
(1)在实验室中,FeCl2可用铁粉和
(2)实验室在制备Fe(OH)2时必须隔绝空气,否则发生的现象是
(3)红砖是用黏土高温烧结而成的,因其含有Fe2O3呈红色或棕红色而得名,常用作建筑材料。请设计一个简单实验证明红砖中含有Fe3+:
(4)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:
您最近一年使用:0次



