下列说法正确的是
| A.活化分子间所发生的碰撞即为有效碰撞 |
| B.能够发生有效碰撞的分子叫做活化分子,活化分子具有的平均能量叫活化能 |
| C.增大反应物浓度,可增大单位体积内活化分子的百分数,从而使反应速率增大 |
| D.升高温度能使化学反应速率增大,是因为增加了反应物中活化分子的百分数 |
更新时间:2024-01-29 14:25:29
|
相似题推荐
单选题
|
较易
(0.85)
名校
【推荐1】下列有关化学反应原理的说法正确的是
| A.强碱和强酸的中和反应的活化能很高,所以化学反应速率很大 |
| B.升高温度,活化分子百分数增大,化学反应速率加快 |
| C.使用催化剂,改变反应历程,降低反应的反应热 |
| D.反应的自发性既能用于判断反应进行的方向,也能用于确定反应发生的速率 |
您最近一年使用:0次
单选题
|
较易
(0.85)
名校
解题方法
【推荐2】已知反应2NO(g) + 2H2(g)⇌N2(g) +2H2O(g),△H1= -752kJ·mol-1 的反应机理如下:
①2NO(g)⇌N2O2(g)(快)
②N2O2(g) + H2(g)⇌N2O(g) + H2O(g)(慢)
③N2O(g) + H2(g)⇌N2(g) +H2O(g)(快)
下列有关说法正确的是
①2NO(g)⇌N2O2(g)(快)
②N2O2(g) + H2(g)⇌N2O(g) + H2O(g)(慢)
③N2O(g) + H2(g)⇌N2(g) +H2O(g)(快)
下列有关说法正确的是
| A.①的逆反应速率小于②的正反应速率 | B.②中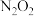 与 与 的碰撞仅部分有效 的碰撞仅部分有效 |
C.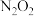 和 和 是该反应的催化剂 是该反应的催化剂 | D.总反应中逆反应的活化能比正反应的活化能小 |
您最近一年使用:0次
单选题
|
较易
(0.85)
【推荐1】NO催化O3分解的反应机理如下:
第一步: ;
;
第二步: ;
;
第三步: 。
。
其能量与反应历程的关系如图所示。下列叙述错误的是

第一步:
 ;
;第二步:
 ;
;第三步:
 。
。其能量与反应历程的关系如图所示。下列叙述错误的是

A.稳定性: | B.第一步反应为决速步骤 |
| C.总反应为2O3(g)→3O2(g) | D.NO降低了总反应释放的能量 |
您最近一年使用:0次
单选题
|
较易
(0.85)
解题方法
【推荐2】多相催化反应是在催化剂表面通过吸附、解吸过程进行的。如图,我国学者发现T℃时,甲醇( )在铜基催化剂上的反应机理如下(该反应为可逆反应):
)在铜基催化剂上的反应机理如下(该反应为可逆反应):
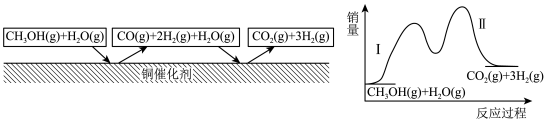
下列有关说法正确的是
 )在铜基催化剂上的反应机理如下(该反应为可逆反应):
)在铜基催化剂上的反应机理如下(该反应为可逆反应):
下列有关说法正确的是
| A.相同条件下,反应Ⅰ和反应Ⅱ相比,反应I的反应速率更快发生 |
B.反应Ⅰ为  |
| C.通过控制催化剂的用量可以控制反应的速率和反应进行的程度 |
D. 与 与 在高温条件下更容易反应 在高温条件下更容易反应 |
您最近一年使用:0次

 )被称为21世纪的“清洁能源”,科学家研究在酸性条件下,用甲醇可合成二甲醚,反应历程中相对能量变化如图所示。
)被称为21世纪的“清洁能源”,科学家研究在酸性条件下,用甲醇可合成二甲醚,反应历程中相对能量变化如图所示。
 是催化剂
是催化剂
 决定
决定 的
的


