几种常见物质之间转化关系如图所示。
(1)A所含元素位于元素周期表第_______ 周期第_______ 族。
(2)C是_______ (填化学式,右同),H是_______ 。
(3)E→F的化学方程式:_______ 。
(4)在氢碘酸溶液中加入少量F,写出离子方程式:_______ 。
(5)在B溶液中加入 溶液,产生固体
溶液,产生固体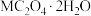 (M是A物质对应的元素)。该固体在空气中加热分解,得到分解产物的热重曲线如图所示。
(M是A物质对应的元素)。该固体在空气中加热分解,得到分解产物的热重曲线如图所示。_______ 。
②b→c的化学方程式为_______ 。
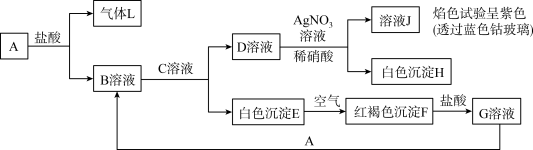
(1)A所含元素位于元素周期表第
(2)C是
(3)E→F的化学方程式:
(4)在氢碘酸溶液中加入少量F,写出离子方程式:
(5)在B溶液中加入
 溶液,产生固体
溶液,产生固体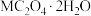 (M是A物质对应的元素)。该固体在空气中加热分解,得到分解产物的热重曲线如图所示。
(M是A物质对应的元素)。该固体在空气中加热分解,得到分解产物的热重曲线如图所示。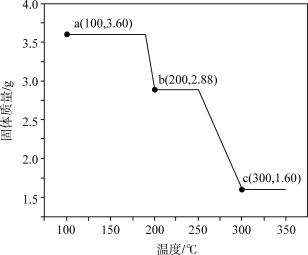
②b→c的化学方程式为
更新时间:2024/02/03 19:32:06
|
相似题推荐
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】FeOOH为一种不溶于水的黄色固体。某学校以 废料(含少量
废料(含少量 、FeO等)为原料制备FeOOH,流程如图所示。
、FeO等)为原料制备FeOOH,流程如图所示。

回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有_______ (填一种即可)。
(2)“废渣”的主要成分可用于_______ (填一种即可)。
(3)“酸浸”时_______ (填“能”或“不能”)使用稀 ,原因是
,原因是_______ 。
(4)“试剂X”可使用_______ (填化学式,填一种即可)。
(5)从“滤液2”中获得晶体的一种方法是:_______ 、过滤、洗涤。
(6)由 转化为FeOOH的离子方程式是
转化为FeOOH的离子方程式是_______ 。
(7)研究晶体性质对工业流程的探究十分重要,该学校的化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
根据以上实验数据,填写表格:
 废料(含少量
废料(含少量 、FeO等)为原料制备FeOOH,流程如图所示。
、FeO等)为原料制备FeOOH,流程如图所示。
回答以下问题:
(1)为提高“酸浸”的速率,可采取的措施有
(2)“废渣”的主要成分可用于
(3)“酸浸”时
 ,原因是
,原因是(4)“试剂X”可使用
(5)从“滤液2”中获得晶体的一种方法是:
(6)由
 转化为FeOOH的离子方程式是
转化为FeOOH的离子方程式是(7)研究晶体性质对工业流程的探究十分重要,该学校的化学社团欲探究A、B、C(均为单质或化合物)三种由H、C、Na、Cl元素组成的晶体。他们对上述物质进行相关实验,数据如下:
| 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 反应 反应 | |
| A | 811 | 较大 | 易溶 | 水溶液或熔融时导电 | 白色沉淀 |
| B | 3550 | 很大 | 不溶 | 不导电 | 不反应 |
| C | -114.2 | 很小 | 易溶 | 液态不导电 | 白色沉淀 |
| 化学式 | 晶体类型 | 微粒间作用力 | |
| A | |||
| B | |||
| C |
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
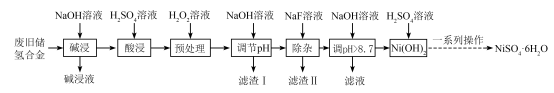
【推荐2】某废旧储氢合金主要含金属Mg、Ni、Al、Fe,还有少量其他不溶性物质。采用如图所示工艺流程回收硫酸镍晶体 。
。
②“除杂”所得滤液的溶质为 和
和 。回答下列问题:
。回答下列问题:
(1)提高“碱浸”速率的有效措施有______________ (任写一种即可)。
(2)“碱浸”过程中发生反应的化学方程式为________________ 。
(3)“预处理”过程中发生反应的离子方程式为______________ 。
(4)“调节 ”时,若溶液中
”时,若溶液中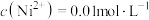 ,则
,则 应控制的范围为
应控制的范围为________ 。
(5)“除杂”过程中所得滤渣Ⅱ的主要成分为_____________ 。
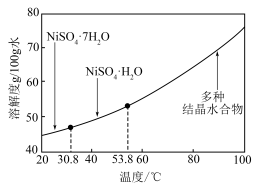
(6)已知镍硫酸盐的溶解度随温度的变化曲线如图,则“一系列操作”的步骤应为控制 、
、_______ 、_______ 、过滤、洗涤、干燥。 常用作电极材料,一种利用太阳能光伏电池电解水交替制备高纯
常用作电极材料,一种利用太阳能光伏电池电解水交替制备高纯 和
和 的装置如图所示。则制
的装置如图所示。则制 时电极3发生的电极反应为
时电极3发生的电极反应为____________ 。
 。
。
| 金属离子 |  |  |  |  |  |
沉淀完全 的 的 | 3.2 | 4.7 | 11.1 | 9.0 | 8.7 |
 和
和 。回答下列问题:
。回答下列问题:(1)提高“碱浸”速率的有效措施有
(2)“碱浸”过程中发生反应的化学方程式为
(3)“预处理”过程中发生反应的离子方程式为
(4)“调节
 ”时,若溶液中
”时,若溶液中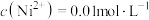 ,则
,则 应控制的范围为
应控制的范围为(5)“除杂”过程中所得滤渣Ⅱ的主要成分为
(6)已知镍硫酸盐的溶解度随温度的变化曲线如图,则“一系列操作”的步骤应为控制
 、
、
 常用作电极材料,一种利用太阳能光伏电池电解水交替制备高纯
常用作电极材料,一种利用太阳能光伏电池电解水交替制备高纯 和
和 的装置如图所示。则制
的装置如图所示。则制 时电极3发生的电极反应为
时电极3发生的电极反应为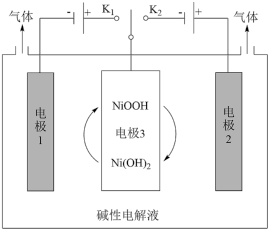
您最近一年使用:0次
解答题-原理综合题
|
适中
(0.65)
名校
解题方法
【推荐3】离子反应是中学化学中重要的反应类型,回答下列问题:
Ⅰ.(1)现有下列物质:①石墨②氢氧化钠溶液③CaCO3④HCl⑤熔融氯化钠⑥CH3COOH⑦CH4⑧蔗糖,其中能导电的是_______ ,属于电解质的是_______ ,属于非电解质的是_______ 。(用序号作答)
(2)写出下列反应离子方程式
①NaHCO3溶液与NaHSO4溶液反应:_________ 。
②NaHCO3溶液与NaOH溶液反应:_______ 。
Ⅱ.某无色混合物水溶液 ,可能含有以下离子中的若干种: 、
、 、
、 、
、 、
、 、
、 、
、 。取100mL该溶液进行如下实验:
。取100mL该溶液进行如下实验:
(1)向该溶液中加入足量稀盐酸,在标准状况下放出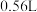 气体
气体 气体体积在标准状况下测定,且不考虑气体溶解
气体体积在标准状况下测定,且不考虑气体溶解 ;
;
(2)向I中所得的滤液中滴加足量 溶液产生白色沉淀
溶液产生白色沉淀 ;试回答下列问题:
;试回答下列问题:
 肯定存在的离子有
肯定存在的离子有_______ ,肯定不存在的离子有______ ;  可能存在的离子是
可能存在的离子是_____ ;  肯定存在的阳离子在原溶液中的物质的量浓度至少为
肯定存在的阳离子在原溶液中的物质的量浓度至少为_____________ ;
 为了检验以上推断,用实验的方法确定溶液中是否存在第一问中肯定存在的阴离子和第三问中可能存在的离子:
为了检验以上推断,用实验的方法确定溶液中是否存在第一问中肯定存在的阴离子和第三问中可能存在的离子:
第一步:向溶液中滴加过量的________ 溶液 填化学式
填化学式 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
第二步:加入过量的_________ 溶液 填化学式
填化学式 ,其目的是
,其目的是_____________ ;
第三步:过滤,再向滤液中加入___________ 溶液 填化学式
填化学式 ,发生反应的离子方程式为
,发生反应的离子方程式为___________ 。
Ⅰ.(1)现有下列物质:①石墨②氢氧化钠溶液③CaCO3④HCl⑤熔融氯化钠⑥CH3COOH⑦CH4⑧蔗糖,其中能导电的是
(2)写出下列反应离子方程式
①NaHCO3溶液与NaHSO4溶液反应:
②NaHCO3溶液与NaOH溶液反应:
Ⅱ.某无色混合物水溶液 ,可能含有以下离子中的若干种:
 、
、 、
、 、
、 、
、 、
、 、
、 。取100mL该溶液进行如下实验:
。取100mL该溶液进行如下实验:(1)向该溶液中加入足量稀盐酸,在标准状况下放出
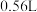 气体
气体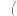 气体体积在标准状况下测定,且不考虑气体溶解
气体体积在标准状况下测定,且不考虑气体溶解 ;
;(2)向I中所得的滤液中滴加足量
 溶液产生白色沉淀
溶液产生白色沉淀 ;试回答下列问题:
;试回答下列问题: 肯定存在的离子有
肯定存在的离子有 可能存在的离子是
可能存在的离子是 肯定存在的阳离子在原溶液中的物质的量浓度至少为
肯定存在的阳离子在原溶液中的物质的量浓度至少为 为了检验以上推断,用实验的方法确定溶液中是否存在第一问中肯定存在的阴离子和第三问中可能存在的离子:
为了检验以上推断,用实验的方法确定溶液中是否存在第一问中肯定存在的阴离子和第三问中可能存在的离子:第一步:向溶液中滴加过量的
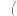 填化学式
填化学式 ,发生反应的离子方程式为
,发生反应的离子方程式为第二步:加入过量的
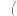 填化学式
填化学式 ,其目的是
,其目的是第三步:过滤,再向滤液中加入
 填化学式
填化学式 ,发生反应的离子方程式为
,发生反应的离子方程式为
您最近一年使用:0次
解答题-工业流程题
|
适中
(0.65)
解题方法
【推荐1】金属钛素有“太空金属”、“海洋金属”、“未来金属”等美誉,我国有丰富的钛矿资源。一种以钛铁矿 ,含
,含 ,等杂质)为主要原料制备钛白粉
,等杂质)为主要原料制备钛白粉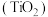 的工艺流程如下图所示。
的工艺流程如下图所示。 不溶于水和稀酸;
不溶于水和稀酸;
②“酸浸”后钛元素主要以 形式存在;
形式存在;
③ 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。
时沉淀完全。
回答下列问题:
(1)提高“酸浸”浸出率的方法有___________ 。
(2)写出“酸浸”操作 发生反应的化学方程式
发生反应的化学方程式___________ 。
(3)滤渣Ⅰ的主要成分为___________ (填写化学式)。
(4)该流程中常加入铁粉来还原体系中的 。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)
。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)___________ 。
②图B所示还原体系中Fe(Ⅲ)的最佳反应温度是___________ ℃。
(5)经处理后,流程中可循环利用有___________ (填写化学式)。
(6)一种电解法制钛的工艺如下图所示,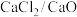 共熔体为介质,在阴极被还原的钙进一步还原
共熔体为介质,在阴极被还原的钙进一步还原 得到钛,在阴极制取钛的相关反应方程式为
得到钛,在阴极制取钛的相关反应方程式为___________ 。
 ,含
,含 ,等杂质)为主要原料制备钛白粉
,等杂质)为主要原料制备钛白粉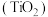 的工艺流程如下图所示。
的工艺流程如下图所示。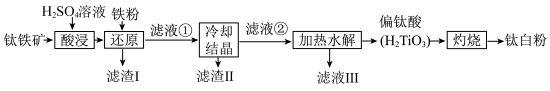
 不溶于水和稀酸;
不溶于水和稀酸;②“酸浸”后钛元素主要以
 形式存在;
形式存在;③
 在
在 时生成沉淀,
时生成沉淀, 时沉淀完全。
时沉淀完全。回答下列问题:
(1)提高“酸浸”浸出率的方法有
(2)写出“酸浸”操作
 发生反应的化学方程式
发生反应的化学方程式(3)滤渣Ⅰ的主要成分为
(4)该流程中常加入铁粉来还原体系中的
 。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)
。某课题研究小组为探究最佳反应条件,在保持相同的反应时间的条件下获得如下探究结果。图A为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随pH的变化图,图B为保持其它反应条件不变,还原体系中Fe(Ⅲ)含量随温度的变化图)
②图B所示还原体系中Fe(Ⅲ)的最佳反应温度是
(5)经处理后,流程中可循环利用有
(6)一种电解法制钛的工艺如下图所示,
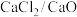 共熔体为介质,在阴极被还原的钙进一步还原
共熔体为介质,在阴极被还原的钙进一步还原 得到钛,在阴极制取钛的相关反应方程式为
得到钛,在阴极制取钛的相关反应方程式为
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
解题方法
【推荐2】某实验小组在实验室进行Fe2+与Fe3+相互转化的实验。___________ 。
(2)试管b中的实验现象是___________ 。
(3)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式___________ 。
(4)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下(w表示质量分数):
①实验i、ii、iii的目的是___________ 。
②小组同学通过实验得出结论:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好,推断的证据是___________ 。
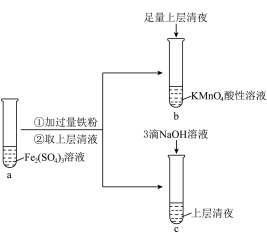
(2)试管b中的实验现象是
(3)试管c中产生白色沉淀,一段时间后部分沉淀变为红褐色。写出白色沉淀变为红褐色的化学方程式
(4)实验小组为探究反应物浓度对Fe(OH)2制备效果的影响,以Fe(OH)2沉淀白色持续时间(t)为指标,t越大,实验效果越好。部分实验数据如下(w表示质量分数):
| 实验 | 序号 | w(FeSO4)/% | w(NaOH)/% | t/s |
| i | 2.5 | 15 | 149 |
| ii | 5 | 15 | 138 | |
| iii | 10 | 15 | 99 | |
| iv | 5 | 25 | 142 | |
| v | 5 | 35 | 180 |
②小组同学通过实验得出结论:其他条件不变时,所用NaOH溶液的浓度越大,实验效果越好,推断的证据是
您最近一年使用:0次
解答题-实验探究题
|
适中
(0.65)
【推荐3】某学生设计了一个制取氢氧化亚铁的实验方案,实验装置如图所示。
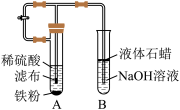
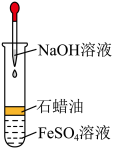
(1)在试管B中加入NaOH溶液,加热煮沸1~2min立即加入2mL液体石蜡,该操作的目的是___________________________________________________________________________________________ 。
(2)在具支试管A中加入稀硫酸和略微过量的铁粉,试分析铁粉过量的原因:______________________ 。
(3)连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时试管A中的现象是___________________________ ,产生该现象的原因是___________________________ 。试管B中的现象为___________________________ 。
(4)若试管B中生成的氢氧化亚铁遇到空气,发生反应的化学方程式为____________________________ 。

(1)在试管B中加入NaOH溶液,加热煮沸1~2min立即加入2mL液体石蜡,该操作的目的是
(2)在具支试管A中加入稀硫酸和略微过量的铁粉,试分析铁粉过量的原因:
(3)连接好导管,同时打开活塞,当铁粉与稀硫酸反应平稳时,关闭活塞,这时试管A中的现象是
(4)若试管B中生成的氢氧化亚铁遇到空气,发生反应的化学方程式为
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
名校
解题方法
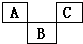
【推荐1】结合元素周期表,完成下列问题。
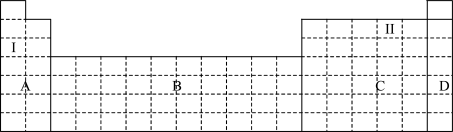
(1)在元素周期表中全部是金属元素的区域为____________ (填序号)。
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为__________________ ,写出其中含有非极性共价键的化合物的电子式_______________ 。
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置__________ 。
②甲、乙两元素中,金属性较强的是__________ (填元素名称),可以验证该结论的实验是_______________ (填序号)。
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性

(1)在元素周期表中全部是金属元素的区域为
a.A b.B c.C d.D
(2)Ⅰ和Ⅱ元素形成的化合物的化学式为
(3)现有甲、乙两种短周期元素,室温下,甲元素的单质在冷的浓硫酸或空气中表面都会生成致密的氧化膜,乙元素原子核外第三层与第一层上的电子数相等。
①写出甲元素周期表中对应的位置
②甲、乙两元素中,金属性较强的是
a.将在空气中放置已久的这两种元素的单质分别放入热水中
b.将这两种元素的单质粉末分别和相同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
您最近一年使用:0次
解答题-无机推断题
|
适中
(0.65)
【推荐2】表中是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)写出元素⑧和⑨的元素符号和元素名称___________ 、___________ 。
(2)写出下下列化学方程式:④的过氧化物跟①的最高价氧化物反应:___________ ,④的最高价氧化物的水化物与⑤的最高价氧化物的水化物反应___________ 。
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | Ⅶ | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)写出下下列化学方程式:④的过氧化物跟①的最高价氧化物反应:
您最近一年使用:0次