阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如图所示:________ ,开始时_________ 极(阴、阳)碱性增强。
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为___________ 。
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为___________ 。
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是___________ (填字母序号)。
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为___________ ,根据原子的性质分析上述判断的理由:___________ 。
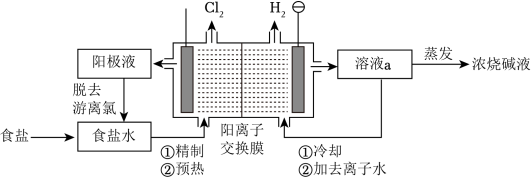
(2)实际生产中,阳离子交换膜的损伤会造成OH-迁移至阳极区,从而在电解池阳极能检测到O2,产生O2的电极反应式为
(3)降低氯碱工业能耗的另一种技术是“氧阴极技术”。通过向阴极区通入O2,避免水电离的H+直接得电子生成H2,降低了电解电压,电耗明显减少。“氧阴极技术”的阴极反应为
(4)电解结束后,能够脱去阳极液中游离氯的试剂或方法是
a.Na2SO4 b.Na2SO3 c.热空气吹出 d.降低阳极区液面上方的气压
(5)食盐水中的I若进入电解槽,可被电解产生的Cl2氧化为ICl。ICl中碘元素的化合价为
更新时间:2024-02-10 17:53:50
|
相似题推荐
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】以黄铜矿(主要成分为CuFeS2)为原料,用(NH4)2S2O8溶液作浸取剂提取铜。
已知:i.S2O 的结构式为
的结构式为 。
。
ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为___________ 。
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是___________ 。
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
①结合离子方程式解释添加Ag+ 可以显著提高Cu元素的浸出率的原因:___________ 。
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:___________ 。
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为___________ 。
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为___________ 。
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:___________ 。
已知:i.S2O
 的结构式为
的结构式为 。
。ii.CuFeS2、Ag2S均能导电。
(1)(NH4)2S2O8有强氧化性,用(NH4)2S2O8溶液作浸取剂浸出CuFeS2的原理示意图如下。

①正极的电极反应式为
②浸取初期,随着浸泡时间延长,Cu2+的浸出速率提高。可能的原因是
(2)在足量 (NH4)2S2O8溶液中添加少量AgNO3溶液作为浸取剂与CuFeS2作用,一段时间结果如下:
| 添加Ag+ | 未加Ag+ | |
| Cu元素的浸出率 | 98.02% | 30.90% |
| 过程中产物形态 |  |  |
②进一步研究发现添加的少量Ag+ 可以多次循环使用,具有类似“催化剂”的作用。其中Ag+“再生”的离子方程式为:
(3)进一步从浸出液中提取铜并使(NH4)2S2O8再生的流程示意图如下。

①在空气中焙烧FeC2O4得到铁红,反应的化学方程式为
②由滤液B电解(Pt作电极)生成(NH4)2S2O8的总反应的离子方程式为
③从能源及物质利用的角度,说明电解滤液B而不直接电解滤液A的优点:
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】请仔细观察下列几种装置的构造示意图,完成下列问题:

(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。结合图1图2,从影响反应速率的因素分析其原因是___________ 。
(2)①已知粗锌中含有的杂质有铝、铁和铜,图3若为电解精炼锌,则A极应接____ (填“粗锌”或“纯锌”),电解一段时间后,电解质溶液中含有的金属阳离子有________ ;
②图3若为铜上镀银装置,已知电镀前A、B电极质量相等,电镀完成后两电极质量差为6.48g时,则电路中通过的电子数为___________ 。
③若图3使用的电源为一种高效耐用的新型可充电电池,其放电反应为:3Zn + 2K2FeO4 + 8H2O = 3Zn(OH)2 +2Fe(OH)3 +4KOH写出该电池放电时正极电极方程式_________ ;
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。图中a极接电源的___________ (填“正”或“负”)极,SO 放电的电极反应式为
放电的电极反应式为___________ 。




(1)碱性锌锰电池比普通锌锰电池(干电池)性能好,放电电流大。结合图1图2,从影响反应速率的因素分析其原因是
(2)①已知粗锌中含有的杂质有铝、铁和铜,图3若为电解精炼锌,则A极应接
②图3若为铜上镀银装置,已知电镀前A、B电极质量相等,电镀完成后两电极质量差为6.48g时,则电路中通过的电子数为
③若图3使用的电源为一种高效耐用的新型可充电电池,其放电反应为:3Zn + 2K2FeO4 + 8H2O = 3Zn(OH)2 +2Fe(OH)3 +4KOH写出该电池放电时正极电极方程式
(3)用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如图所示(电极材料为石墨)。图中a极接电源的
 放电的电极反应式为
放电的电极反应式为
您最近一年使用:0次
【推荐3】(1)下列有关电化学的图示中,完全正确的是_____________
A.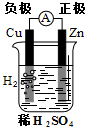 Cu-Zn原电池 B.
Cu-Zn原电池 B.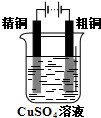 粗铜精炼
粗铜精炼
C.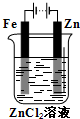 铁片镀锌 D.
铁片镀锌 D.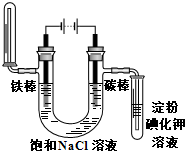 验证气体产物
验证气体产物
(2)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中可与碘化物作用生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。
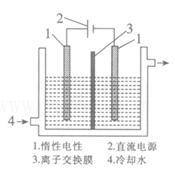
请回答下列问题:
a.碘是_________ (填颜色)固体物质,实验室常用_______ 方法来分离提纯含有少量泥沙杂质的固体碘。
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH==5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________ ,每生成1mol KIO3,电路中通过的电子的物质的量为________ 。
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表。
可供选择的试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸(用其中的一种或多种均可。)
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是______________ ,步骤⑤的操作名称是________ 。步骤④洗涤晶体的目的是_________________ 。
A.
 Cu-Zn原电池 B.
Cu-Zn原电池 B. 粗铜精炼
粗铜精炼C.
 铁片镀锌 D.
铁片镀锌 D. 验证气体产物
验证气体产物(2)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中可与碘化物作用生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。

请回答下列问题:
a.碘是
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH==5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表。
可供选择的试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸(用其中的一种或多种均可。)
| 实验方法 | 实验现象及结论 |
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐1】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:
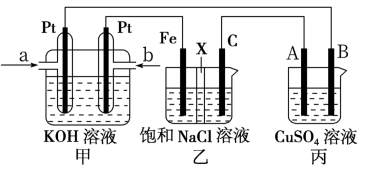
(1)从 b口通入的气体发生的电极反应为______________________________ 。
(2)写出乙中发生的总反应的离子方程式为________________________________ 。
(3)当b口消耗标况下2.24L的气体时,则A极增重质量为__________________

(1)从 b口通入的气体发生的电极反应为
(2)写出乙中发生的总反应的离子方程式为
(3)当b口消耗标况下2.24L的气体时,则A极增重质量为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】化学电源在日常生活和工业生产中有着重要的应用。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题

(1)甲烷燃料电池负极反应式是______________________ 。
(2)石墨(C)极的电极反应式为______________________ 。
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为___________ L;丙装置中阴极析出铜的质量为___________ g,一段时间后烧杯中c(Cu2+)___________ (填“增大”、“减小”或“不变”)
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:

(4)从a口加入___________ (填名称)。H+移动方向是___________ (填“A到B”或“B到A”)
(5)A极发生的电极反应式:______________________ 。
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是___________ 。
I.如下图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题

(1)甲烷燃料电池负极反应式是
(2)石墨(C)极的电极反应式为
(3)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁极上生成的气体体积为
Ⅱ.“长征”火箭发射使用的燃料是液态偏二甲肼(C2H8N2),并使用四氧化二氮作为氧化剂,这种组合的两大优点是,既能在短时间内产生巨大能量将火箭送上太空,产物又不污染空气(产物都是空气成分)。某校外研究性学习小组拟将此原理设计为原电池,如图所示,结合学习过的电化学原理分析其设计方案,回答相关问题:

(4)从a口加入
(5)A极发生的电极反应式:
(6)若以该电池为电源用石墨做电极电解200mL0.5mol/L的CuSO4溶液,电解一段时间后,两极收集到相同体积(相同条件)的气体,则整个电解过程转移的电子的数目是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐3】合成氨是人类科学技术上的一项重大突破,氨有广泛的应用。
已知:
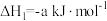
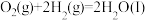
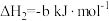
(1)由 与
与 反应生成
反应生成 的热化学方程式是
的热化学方程式是
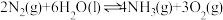

___________ 
(2)工业上主要以 、
、 为原料气合成
为原料气合成 。
。
将物质的量之比为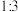 的
的 和
和 充入
充入 的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
①该条件下 的转化率为
的转化率为___________ ,平衡常数
___________ (本题均可用分数表示):
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为___________ (填“正向”、“逆向”或“无法判断”)。
③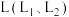 、X可分别代表压强或温度。图1表示L一定时,合成氨反应中
、X可分别代表压强或温度。图1表示L一定时,合成氨反应中 的平衡转化率随X的变化关系。
的平衡转化率随X的变化关系。

i.X代表的物理量是_______________ 。
ⅱ.判断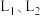 的大小关系,并简述理由
的大小关系,并简述理由__________________ 。
(3)电化学气敏传感器可用于检测环境中 的含量,其工作原理如图2所示,则a极的电极反应式为
的含量,其工作原理如图2所示,则a极的电极反应式为______________________ 。

已知:

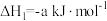
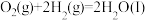
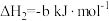
(1)由
 与
与 反应生成
反应生成 的热化学方程式是
的热化学方程式是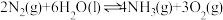


(2)工业上主要以
 、
、 为原料气合成
为原料气合成 。
。将物质的量之比为
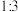 的
的 和
和 充入
充入 的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:
的密闭容器中,在一定条件下达到平衡,测得平衡时数据如下:物质 |
|
|
|
平衡时物质的量/ | 0.2 | 0.6 | 0.2 |
 的转化率为
的转化率为
②若按以下浓度投料,其它反应条件与①相同,起始时反应进行的方向为
物质 |
|
|
|
起始浓度( | 0.5 | 1.5 | 0.5 |
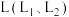 、X可分别代表压强或温度。图1表示L一定时,合成氨反应中
、X可分别代表压强或温度。图1表示L一定时,合成氨反应中 的平衡转化率随X的变化关系。
的平衡转化率随X的变化关系。
i.X代表的物理量是
ⅱ.判断
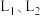 的大小关系,并简述理由
的大小关系,并简述理由(3)电化学气敏传感器可用于检测环境中
 的含量,其工作原理如图2所示,则a极的电极反应式为
的含量,其工作原理如图2所示,则a极的电极反应式为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液; X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为_______ ;
②Y电极上的电极反应式为_______ 。
(2)如要用电解方法精炼粗铜,电解液选用硫酸铜溶液,则:
①X电极的材料是_______ ,电极反应式为_______ ;
②Y电极的材料是_______ ,电极反应式为_______ 。

(1)若X、Y都是惰性电极,是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则:
①电解池中X极上的电极反应式为
②Y电极上的电极反应式为
(2)如要用电解方法精炼粗铜,电解液选用硫酸铜溶液,则:
①X电极的材料是
②Y电极的材料是
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
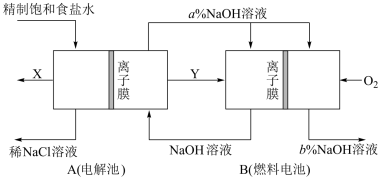
【推荐2】氯碱工业是以电解饱和食盐水为基础的基本化学工业。如图是某氯碱工业生产原理示意图:
(1)写出装置A在通电条件下反应的化学方程式:___ 。
(2)装置A所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+和Ca2+,要加入的试剂分别为___ 、__ 。
(3)氯碱工业是高耗能产业,按图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是___ (填化学式);X与稀NaOH溶液反应的离子方程式为___ 。
②比较图示中氢氧化钠的质量分数a%与b%的大小:a%___ b%。
A.大于 B.小于 C.等于 D.无法确定
③若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置A中产生X为__ mol。

(1)写出装置A在通电条件下反应的化学方程式:
(2)装置A所用食盐水由粗盐水精制而成。精制时,为除去食盐水中的Mg2+和Ca2+,要加入的试剂分别为
(3)氯碱工业是高耗能产业,按图将电解池与燃料电池相组合的新工艺可以节(电)能30%以上,相关物料的传输与转化关系如图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。
①图中Y是
②比较图示中氢氧化钠的质量分数a%与b%的大小:a%
A.大于 B.小于 C.等于 D.无法确定
③若用装置B作为装置A的辅助电源,每当消耗标准状况下氧气的体积为11.2L时,则装置A中产生X为
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐3】A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转换关系 (部分反应中得水已忽略)
(1)若A为氯碱工业的产品,C为厨房中的用品。
①反应Ⅰ的离子方程式为____________________________________________ ;
②氯碱工业制备A的化学方程式是__________________________________________________ 。
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①B溶液可净水的原因是____________________________________________ ;
②A的实验制法的化学方程式____________________________________________ 。
(3)若B是一种两性氢氧化物,请写出反应Ⅲ的离子方程式____________________________________ 。
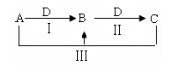
(1)若A为氯碱工业的产品,C为厨房中的用品。
①反应Ⅰ的离子方程式为
②氯碱工业制备A的化学方程式是
(2)若A、D均为单质,且A为气体,D元素的一种红棕色氧化物常用作颜料。
①B溶液可净水的原因是
②A的实验制法的化学方程式
(3)若B是一种两性氢氧化物,请写出反应Ⅲ的离子方程式
您最近一年使用:0次


 )
)

