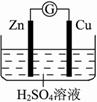
(1)下列有关电化学的图示中,完全正确的是_____________
A.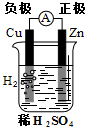 Cu-Zn原电池 B.
Cu-Zn原电池 B.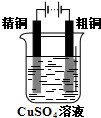 粗铜精炼
粗铜精炼
C.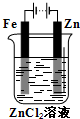 铁片镀锌 D.
铁片镀锌 D.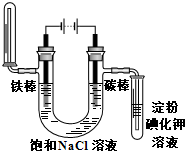 验证气体产物
验证气体产物
(2)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中可与碘化物作用生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。
请回答下列问题:
a.碘是_________ (填颜色)固体物质,实验室常用_______ 方法来分离提纯含有少量泥沙杂质的固体碘。
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH==5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为________ ,每生成1mol KIO3,电路中通过的电子的物质的量为________ 。
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表。
可供选择的试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸(用其中的一种或多种均可。)
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是______________ ,步骤⑤的操作名称是________ 。步骤④洗涤晶体的目的是_________________ 。
A.
 Cu-Zn原电池 B.
Cu-Zn原电池 B. 粗铜精炼
粗铜精炼C.
 铁片镀锌 D.
铁片镀锌 D. 验证气体产物
验证气体产物(2)碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水。碘酸钾在酸性介质中可与碘化物作用生成单质碘。以碘为原料,通过电解制备碘酸钾的实验装置如图所示。

请回答下列问题:
a.碘是
b.电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH==5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为
c.电解过程中,为确定电解是否完成,需检验电解液中是否有I-。请设计一个检验电解液中是否有I-的简单实验方案,并按要求填写下表。
可供选择的试剂:淀粉溶液、淀粉-KI试纸、过氧化氢溶液、稀硫酸(用其中的一种或多种均可。)
| 实验方法 | 实验现象及结论 |
d.电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
阳极电解液→①蒸发浓缩→②→③过滤→④洗涤→⑤→碘酸钾晶体
步骤②的操作名称是
11-12高三上·黑龙江牡丹江·期末 查看更多[1]
(已下线)2011届黑龙江省牡丹江一中高三上学期期末考试化学试卷
更新时间:2016-12-08 17:36:37
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)现有如下两个反应:
A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A._____ ,B._____ 。(填“能”或“不能”)
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是____________ 。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲________ 乙(填“>”、“<“或“=”)。
③请写出图中构成原电池的负极电极反应式_________________________ 。
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入__ 极(填a或b),电子从____ (填a或b)极流出。
(1)现有如下两个反应:
A.NaOH+HCl=NaCl+H2O;B.Zn+H2SO4=ZnSO4+H2↑
判断能否设计成原电池A.
(2)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的pH均增大
②在相同时间内,两烧杯中产生气泡的速度:甲
③请写出图中构成原电池的负极电极反应式
(3)燃料电池的工作原理是将燃料和氧化剂(如O2)反应所放出的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,氢气为燃料,采用氢氧化钠溶液为电解液;则氢气应通入
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。将锌片和铜片插入相同浓度的稀硫酸中,如图所示:
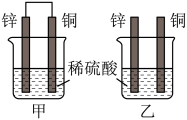
回答下列问题:
(1)下列说法正确的是________ 。
a.甲、乙均为化学能转变为电能的装置
b.甲中锌片是负极,乙中铜片是正极
c.甲、乙溶液中的pH均增大
d.若将稀硫酸换为硫酸铜溶液,则甲、乙中铜片的质量均增加
(2)甲、乙中构成原电池的正极电极反应式为_________ ,原电池工作过程中,电流由_________ (填“铜片”或“锌片”)经导线流向___________ (填“铜片”或“锌片”);溶液中的 向
向________ (填“正极”或“负极”)移动。
(3)当甲中溶液质量增重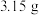 时,电极上转移电子数目为
时,电极上转移电子数目为_________ ,生成的氢气在标准状况下的体积为________ 。
(4)对甲、乙装置做如下变化后,可形成原电池的是__________ 。
a.甲中铜片换成锌片
b.乙中锌片和铜片相互倾斜至上端接触
c.甲中稀硫酸用乙醇代替

回答下列问题:
(1)下列说法正确的是
a.甲、乙均为化学能转变为电能的装置
b.甲中锌片是负极,乙中铜片是正极
c.甲、乙溶液中的pH均增大
d.若将稀硫酸换为硫酸铜溶液,则甲、乙中铜片的质量均增加
(2)甲、乙中构成原电池的正极电极反应式为
 向
向(3)当甲中溶液质量增重
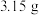 时,电极上转移电子数目为
时,电极上转移电子数目为(4)对甲、乙装置做如下变化后,可形成原电池的是
a.甲中铜片换成锌片
b.乙中锌片和铜片相互倾斜至上端接触
c.甲中稀硫酸用乙醇代替
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
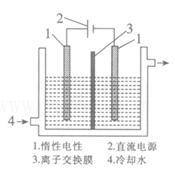
【推荐1】如图是利用氯碱工业的原理图。回答下列问题:
(1)请写出氯碱工业的电极反应方程式:__ ,__ 。(注明电极)
(2)图中的离子交换膜是__ (填“阳离子”或“阴离子”)交换膜,采用该离子交换膜的作用有__ (写出一点)。
(3)请写出检验左室气体产物的方法__ 。
(4)请写出NaOH在工业上的一种用途__ 。

(1)请写出氯碱工业的电极反应方程式:
(2)图中的离子交换膜是
(3)请写出检验左室气体产物的方法
(4)请写出NaOH在工业上的一种用途
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐2】某同学设计了如下燃料电池,并探究氯碱工业原理的相关问题(其中乙装置中为正离子交换膜)。

(1)乙中石墨电极(C)作___________ 极。若丙中W为 溶液,且滴有酚酞,当实验开始后观察到的现象是
溶液,且滴有酚酞,当实验开始后观察到的现象是_______________________ 。
(2)若消耗2.24L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为___________ L。
(3)若丙中以 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
(4)若丙中以稀 为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为
为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为___________________ 。
(5)假设乙装置中氯化钠溶液足够多,且装置中X为正离子交换膜,则反应后左侧溶液质量将___________ (填“增大”“减小”或“不变”)。

(1)乙中石墨电极(C)作
 溶液,且滴有酚酞,当实验开始后观察到的现象是
溶液,且滴有酚酞,当实验开始后观察到的现象是(2)若消耗2.24L(标况)氧气,则乙装置中铁电极上生成的气体体积(标况)为
(3)若丙中以
 溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。| A.b电极为粗铜 | B.粗铜接电源正极,发生还原反应 |
C. 溶液的浓度保持不变 溶液的浓度保持不变 | D.利用阳极泥可回收Ag、Pt、Au等金属 |
(4)若丙中以稀
 为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为
为电解质溶液,电极材料b为铝,则能使铝表面生成一层致密的氧化膜。则该电极反应式为(5)假设乙装置中氯化钠溶液足够多,且装置中X为正离子交换膜,则反应后左侧溶液质量将
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
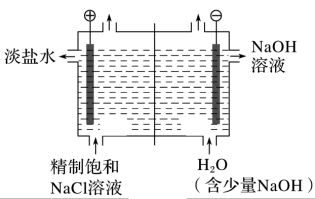
【推荐3】电化学原理广泛应用于日常生活、生产和科学技术等方面,以满足不同的需要。根据如图所示装置,分别回答下列问题:
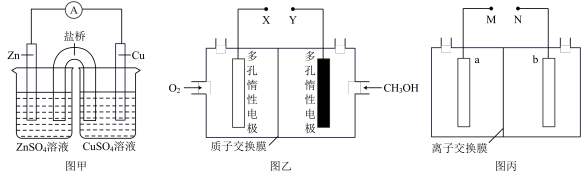
(1)图甲中电极电势Zn______ Cu(填“高于”、“低于”);盐桥中装有KCl饱和溶液,电池工作时盐桥中 将
将______
A.移向 溶液 B.移向
溶液 B.移向 溶液 C.不移动
溶液 C.不移动
(2)图乙为使用酸性电解液的甲醇燃料电池的工作原理示意图,其负极电极反应式为___________ ,工作时若消耗32g甲醇,则理论上左室溶液质量变化值为______ g
(3)图丙为模拟离子交换膜法电解饱和食盐水原理示意图,若以图乙装置为电源,a电极区得到烧碱溶液,则N应与图乙中______ 相连(填“X”、“Y”),图丙中用到______ 离子交换膜(填“阴”、“阳”),电解总反应离子方程式为__________________
(4)若将图丙中a、b电极换成Fe电极电解处理含 的废水,阳极电极反应式为
的废水,阳极电极反应式为______ ;25℃时,阳极区产生的离子将 转化为
转化为 后调节pH为5时,
后调节pH为5时, 完全沉淀(离子浓度为
完全沉淀(离子浓度为 ),调节溶液pH为7时,溶液中
),调节溶液pH为7时,溶液中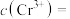
______ 

(1)图甲中电极电势Zn
 将
将A.移向
 溶液 B.移向
溶液 B.移向 溶液 C.不移动
溶液 C.不移动(2)图乙为使用酸性电解液的甲醇燃料电池的工作原理示意图,其负极电极反应式为
(3)图丙为模拟离子交换膜法电解饱和食盐水原理示意图,若以图乙装置为电源,a电极区得到烧碱溶液,则N应与图乙中
(4)若将图丙中a、b电极换成Fe电极电解处理含
 的废水,阳极电极反应式为
的废水,阳极电极反应式为 转化为
转化为 后调节pH为5时,
后调节pH为5时, 完全沉淀(离子浓度为
完全沉淀(离子浓度为 ),调节溶液pH为7时,溶液中
),调节溶液pH为7时,溶液中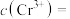

您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】Ⅰ.某学习小组将有关“电解饱和食盐水”的相关内容进行梳理,形成如下问题(显示的电极均为石墨)
(1)利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分 NaClO,则c 为电源的_______ 极;该发生器中反应的总离子方程式为_______ 。
(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取 ClO2的新工艺。

①阳极产生ClO2的电极反应式:_______ 。
②当阴极产生标准状况下 112mL 气体时,通过阳离子交换膜离子的物质的量为_______ 。
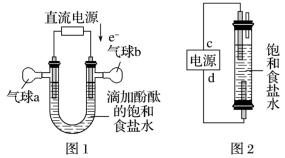
Ⅱ.化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解 NO 原理如图所示。
原理如图所示。
(3)电源正极为_______ (填A 或 B),阴极反应式为_______ 。
(4)若电解过程中转移了 2mol 电子,则膜两侧电解液的质量变化差(Δm 左-Δm右)为_______ g。
(1)利用图 2 制作一种环保型消毒液发生器,电解可制备“84”消毒液的有效成分 NaClO,则c 为电源的

(2)二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂。如图是目前已开发出用电解法制取 ClO2的新工艺。

①阳极产生ClO2的电极反应式:
②当阴极产生标准状况下 112mL 气体时,通过阳离子交换膜离子的物质的量为
Ⅱ.化学在环境保护中起着十分重要的作用,催化反硝化法和电化学降解法可用于治理水中硝酸盐的污染。电化学降解 NO
 原理如图所示。
原理如图所示。
(3)电源正极为
(4)若电解过程中转移了 2mol 电子,则膜两侧电解液的质量变化差(Δm 左-Δm右)为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
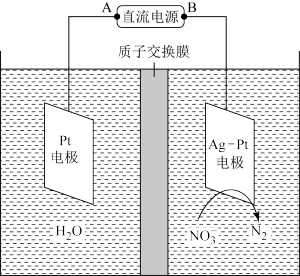
【推荐2】电解装置如图所示:
Ⅰ.当用惰性电极电解时,c为____________ 极, d极的电极反应_________ ,电解总反应的化学方程____________________
Ⅱ.(1)若用此装置进行铁上镀铜则c为__________ (填铁或铜),电解液浓度_____________ (增大,减小或不变)
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子___________ mol.
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极________ (填图中的字母)。

Ⅰ.当用惰性电极电解时,c为
Ⅱ.(1)若用此装置进行铁上镀铜则c为
(2)电镀一段时间后对电极进行称量发现两极质量差为16克,则电路中转移的电子
Ⅲ.若用此装置进行粗铜的电解精炼。则要求粗铜板是图中电极
您最近一年使用:0次
【推荐3】氢气是一种理想的“绿色能源”,下图为氢能产生与利用的途径:

(1) 氢气是一种________ (选填“可再生”或“不可再生”)能源。上图中 4 个过程中能量转化形式有_______ 。
A 2 种 B 3 种 C 4 种 D 4 种以上
(2) 电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
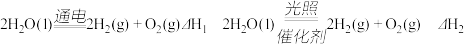
①以上反应的△H1_____ △H2(选填“>”、“<”或“=”)。
②电解水一段时间后,若阴极析出 224 mL(标准状况下)气体,则电路在通过的电子_____ mol。
(3)已知 H2O(l)= H2O(g) △H= +44 kJ/mol,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式_____ ,若 4 g 氢气燃烧生成液态水时放出的热量是_____ kJ。
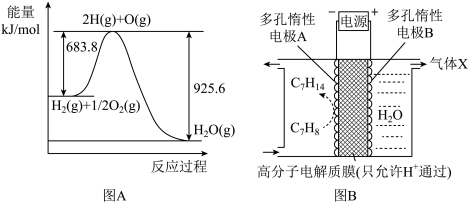
(4) 氢能利用需要选择合适的储氢材料。一定条件下,如图 B 所示装置可实现有机物的电化学储氢,总反应:2C7H8+ H2O(l)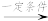 2C7H14 + 3O2(g)电解过程中产生的气体 X 为
2C7H14 + 3O2(g)电解过程中产生的气体 X 为____ 。

(1) 氢气是一种
A 2 种 B 3 种 C 4 种 D 4 种以上
(2) 电解过程要消耗大量电能,而使用微生物作催化剂在阳光下即可分解
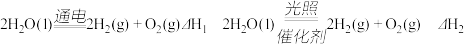
①以上反应的△H1
②电解水一段时间后,若阴极析出 224 mL(标准状况下)气体,则电路在通过的电子
(3)已知 H2O(l)= H2O(g) △H= +44 kJ/mol,依据右图能量变化写出氢气燃烧生成液态水的热化学方程式

(4) 氢能利用需要选择合适的储氢材料。一定条件下,如图 B 所示装置可实现有机物的电化学储氢,总反应:2C7H8+ H2O(l)
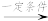 2C7H14 + 3O2(g)电解过程中产生的气体 X 为
2C7H14 + 3O2(g)电解过程中产生的气体 X 为
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
【推荐1】因在航空、核能、电池等高技术领域的重要作用——锂被称为“21世纪的能源金属”。三位科学家因在锂离子电池研发领域作出的贡献而获2019年诺贝尔化学奖。完成下列填空:
(1)锂位于元素周期表的___ 。已知金属熔点:锂>钠>钾,请根据晶体结构理论解释原因:___ 。
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式__ ,LiH中阴离子半径大于阳离子半径,其原因是___ 。
(3)工业上用Li2CO3制取锂的化合物及金属锂。用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:____ Li2CO3+____Br2+____NH3·H2O→______LiBr+______+ ______。
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:___ 、___ 、过滤、用乙醇洗涤,干燥。
(1)锂位于元素周期表的
(2)氢化锂(LiH)是离子化合物,写出其阴离子的电子式
(3)工业上用Li2CO3制取锂的化合物及金属锂。用Li2CO3、氨水和液溴制备LiBr·H2O的流程如下:

合成时,除生成LiBr外,还产生了两种参与大气循环的气体,补全产物并配平该反应的化学方程式:
②溴化锂的溶解度随温度变化曲线如图所示,请补全从溶液中得到LiBr·H2O晶体的实验步骤:

您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐2】唐朝初年,瘟疫频发,人们把它归因于一种叫“年”的怪兽。一位叫李田的人就把硝石、硫磺和木炭装在竹筒里,点燃后驱赶怪兽。后来人们靠此驱散了山林瘴气,战胜了疫情。中国古代四大发明之一的“黑火药”是由“一硫二硝三木炭”混合而成。
(1)写出“黑火药”爆炸的化学反应方程式_______ 。
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是_______ (用文字表述,任写一条合理途径)。
(3)古代曾用硝土[含有 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:

①“反应”过程中的离子反应方程式为_______ 。
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和_______ ;
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液_______ 、过滤洗涤、干燥等步骤。
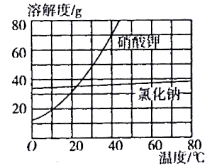
(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油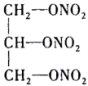 (
(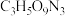 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为_______ ;
②实验室制备硝化甘油的化学方程式为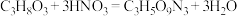 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
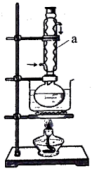
该装置中仪器a名称为_______ ,采用水浴加热而不用酒精灯直接加热的原因是_______ ,从反应后混合溶液中分离硝化甘油的简单方法是_______ 。
(1)写出“黑火药”爆炸的化学反应方程式
(2)“黑火药”爆炸时,空气中还弥漫着一层淡淡的刺鼻的SO2气体,它能在一定程度上,杀灭空气中的细菌。日常生产生活中,产生该气体的主要途径是
(3)古代曾用硝土[含有
 、少量NaCl等]和草木灰(含有
、少量NaCl等]和草木灰(含有 )作原料制取
)作原料制取 。某化学兴趣小组设计了如下实验流程:
。某化学兴趣小组设计了如下实验流程:
①“反应”过程中的离子反应方程式为
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和
③如图所示是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括将滤液

(4)现代国防开矿等使用的烈性炸药,主要成分为硝化甘油
 (
(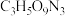 ),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。
),它是一种白色或淡黄色黏稠液体,低温易冻结。熔点13℃,沸点218℃(170℃以上会发生爆炸),密度是水的1.6倍。①硝化甘油在人体内能缓慢分解出一种双原子明星分子,其相对分子量是30,少量的该分子在人体内会促进血管扩张,防止血管栓塞,因此,被广泛用于治疗心绞痛,该明星分子的化学式为
②实验室制备硝化甘油的化学方程式为
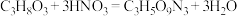 ,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
,用浓硝酸、浓硫酸和甘油混合加热到85℃以上,即得到硝化甘油,制备装置如图所示。
该装置中仪器a名称为
您最近一年使用:0次
【推荐3】现在工业上主要采用离子交换膜法电解饱和食盐水制取H2、Cl2、NaOH,请回答下列问题:
(1)在电解过程中,与电源正极相连的电极上发生的电极反应为__ ;
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有a:Na2CO3溶液,b:Ba(OH)2溶液,c:稀盐酸,其合理的加入顺序为___ 。
(3)如果在容积为10L的离子交换膜电解槽中,1min在阴极可产生标况下11.2L的H2,这时溶液中OH-的物质的量浓度为__ ;
(4)Cl2常用于自来水消毒杀菌,现有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需的Cl2和ClO2的物质的量之比为:__ 。
(1)在电解过程中,与电源正极相连的电极上发生的电极反应为
(2)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO42-等杂质离子,使用的试剂有a:Na2CO3溶液,b:Ba(OH)2溶液,c:稀盐酸,其合理的加入顺序为
(3)如果在容积为10L的离子交换膜电解槽中,1min在阴极可产生标况下11.2L的H2,这时溶液中OH-的物质的量浓度为
(4)Cl2常用于自来水消毒杀菌,现有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需的Cl2和ClO2的物质的量之比为:
您最近一年使用:0次