研究微生物燃料电池不仅可以获得高效能源,同时还可对污水、餐厅废弃物等进行科学处理。利用微生物燃料电池原理处理含乙酸的废水的示意图如图所示。下列说法正确的是
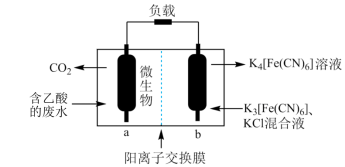

| A.放电过程中b极附近溶液的pH变大 |
B.负极反应式为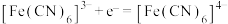 |
C.消耗 时外电路转移0.8mole- 时外电路转移0.8mole- |
| D.该电池在高温下放电效率更高 |
更新时间:2024-02-28 09:37:46
|
相似题推荐
单选题
|
较难
(0.4)
名校
【推荐1】微信山城学术圈刊登了一种Zn﹣PbO2电池,电解质为K2SO4、H2SO4和KOH,通过a和b两种离子交换膜将电解质溶液隔开(减少参加电极反应的离子的迁移更有利于放电),形成M、R、N三个电解质溶液区域,结构示意图如图所示。下列说法正确的是

| A.a为阴离子交换膜,b为阳离子交换膜 |
| B.电池放电后R区域的电解质溶液浓度增大 |
C.充电时,Zn电极反应为Zn﹣2e﹣+4OH﹣=Zn(OH) |
| D.放电时,消耗13gZn,N区域电解质溶液减少39.2g |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
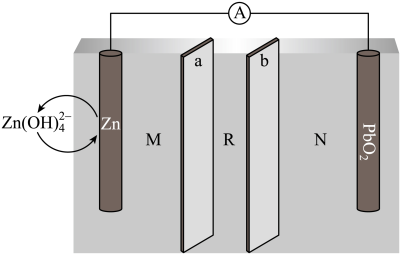
【推荐2】浓差电池是一种利用电解质溶液浓度差产生电势差而形成的电池,理论上当电解质溶液的浓度相等时停止放电。图1为浓差电池,图2为电渗析法制备磷酸二氢钠,用浓差电池为电源完成电渗析法制备磷酸二氢钠。下列说法正确的是
| A.电极Ag(II)的电极反应式为:Ag-e-=Ag+ |
| B.电渗析装置中膜a、b均为阳离子交换膜 |
| C.电渗析过程中左室中NaOH浓度增大,右室H2SO4的浓度减小 |
| D.电池从开始到停止放电,理论上可制备2.4gNaH2PO4 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐3】某小组同学设计如下实验能证实反应2Fe3++2I-=2Fe2++I2为可逆反应。已知 是一种无色的稳定的络离子。
是一种无色的稳定的络离子。
下列说法不正确的是
 是一种无色的稳定的络离子。
是一种无色的稳定的络离子。| 实验装置 | 实验序号 | 实验操作和现象 |
 注:a、b均为石墨电极 | ① | ⅰ.闭合K,指针向右偏转 ⅱ.待指针归零,向U形管左管中加入1mol/LKI溶液,∙∙∙∙∙∙ |
| ② | ⅰ.闭合K,指针向右偏转 ⅱ.待指针归零,向U形管左管中滴加0.01mol/LAgNO3溶液,指针向左偏转。 |
| A.电流表指针归零,说明上述可逆反应达到了化学平衡状态 |
| B.①中加入KI溶液后,上述平衡向正反应方向移动,电流表指针向右偏转 |
| C.②中加入AgNO3溶液后,导致氧化性:Fe3+ >I2,上述平衡向逆反应方向移动 |
| D.②中电流表指针再次归零时,向U型管右管滴加饱和NH4F溶液,电流表指针向左偏转 |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】利用下图所示装置可合成己二腈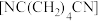 。充电时生成己二腈,放电时生成
。充电时生成己二腈,放电时生成 ,其中a、b是互为反置的双极膜,双极膜中的
,其中a、b是互为反置的双极膜,双极膜中的 会解离出
会解离出 和
和 向两极移动。下列说法错误的是
向两极移动。下列说法错误的是
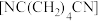 。充电时生成己二腈,放电时生成
。充电时生成己二腈,放电时生成 ,其中a、b是互为反置的双极膜,双极膜中的
,其中a、b是互为反置的双极膜,双极膜中的 会解离出
会解离出 和
和 向两极移动。下列说法错误的是
向两极移动。下列说法错误的是
| A.放电时,N极的电势低于M极的电势 |
B.放电时,双极膜中 向N极移动 向N极移动 |
C.充电时,N极的电极反应式为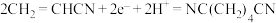 |
D.若充电时制得1mol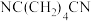 ,则放电时需生成1mol ,则放电时需生成1mol ,才能使左室溶液恢复至初始状态 ,才能使左室溶液恢复至初始状态 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】一种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、比能量(即电池单位质量或者单位体积所输出电能的多少)高、效率好等优点,以此二甲醚燃料电池为电源进行电解的实验装置如图所示。下列说法正确的是
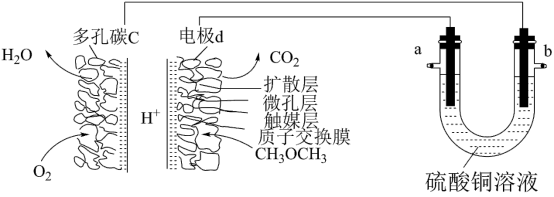

| A.多孔碳c能增大气固接触面积,提高反应速率,该电极为负极 |
| B.燃料电池工作时,电极d上发生的反应为:CH3OCH3+12e-+3H2O=2CO2+12H+ |
| C.二甲醚直接燃料电池的比能量(kW•h•kg-1)约为甲醇(CH3OH)直接燃料电池比能量的1.4倍 |
| D.a极是纯铜,b极是粗铜时,a极上有铜析出,b极逐渐溶解,两极质量变化相同 |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐1】某大学研究团队推出一种新型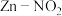 电池。该电池能有效地捕获
电池。该电池能有效地捕获 ,将其转化为
,将其转化为 ,再将产生的
,再将产生的 电解制氨,过程如图所示。下列说法正确的是
电解制氨,过程如图所示。下列说法正确的是
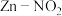 电池。该电池能有效地捕获
电池。该电池能有效地捕获 ,将其转化为
,将其转化为 ,再将产生的
,再将产生的 电解制氨,过程如图所示。下列说法正确的是
电解制氨,过程如图所示。下列说法正确的是
A. 电极的电势比 电极的电势比 电极的电势高 电极的电势高 |
B. 的空间结构为平面三角形 的空间结构为平面三角形 |
C. 极的电极反应为 极的电极反应为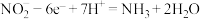 |
D.电路中转移0.2mol 时,理论上能得到1.12L 时,理论上能得到1.12L |
您最近一年使用:0次
单选题
|
较难
(0.4)
【推荐2】工业上一种脱除和利用工厂废气中CO2的方法示意图如图所示,已知某温度下H2CO3的Ka1=4.6×10-7,Ka2=5.0×10-11,lg5=0.7。
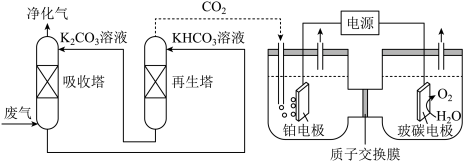
下列说法正确的是

下列说法正确的是
| A.吸收塔和再生塔发生的反应互为可逆反应 |
B.某温度下,吸收塔中溶液pH=9.3,则溶液的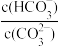 =10 =10 |
| C.玻碳电极上的电极反应为:2H2O+4e-=O2↑+4H+ |
D.若电流效率为50%,当CO2电催化生成0.4molHCOOH时,正极区产生气体的体积为4.48L(标准状况)(电流效率=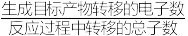 ×100%) ×100%) |
您最近一年使用:0次
单选题
|
较难
(0.4)
名校
【推荐1】微生物燃料电池在净化废水的同时能获得能源或得到有价值的化学产品,图甲为其工作原理,图乙为废水中 离子浓度与去除率的关系。下列说法正确的是
离子浓度与去除率的关系。下列说法正确的是
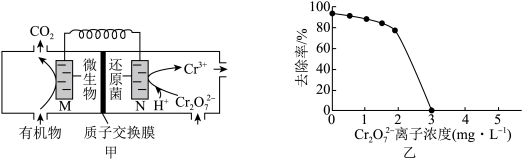
 离子浓度与去除率的关系。下列说法正确的是
离子浓度与去除率的关系。下列说法正确的是
| A.外电路中电流从M流向N |
| B.电池工作一段时间后,N极附近溶液pH降低 |
C. 离子浓度较大时,去除率降低的原因与细菌活性无关 离子浓度较大时,去除率降低的原因与细菌活性无关 |
D.若有机物为HCHO,还原1 mol ,左侧溶液质量减少27 g ,左侧溶液质量减少27 g |
您最近一年使用:0次
单选题
|
较难
(0.4)
解题方法
【推荐2】根据下列实验现象所得结论正确的是
| 选项 | 实验 | 现象 | 结论 |
| A | 向某溶液中滴加氯水,再滴加KSCN溶液 | 溶液变成红色 | 该溶液中一定含有Fe2+ |
| B | 取少量铁与水蒸气反应后的固体,先加入稀盐酸再加KSCN溶液 | 溶液呈浅绿色 | 样品中没有+3价铁 |
| C | 向蛋白质溶液中加入CuCl2或 饱和溶液 饱和溶液 | 均有沉淀 | 蛋白质均发生了变性 |
| D | 向0.1mol/LMgSO4溶液缓慢滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 白色沉淀逐渐变为蓝色沉淀 | 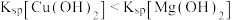 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次

 Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH- +3H2O=2Al(OH)3↓+3CO2↑
+3H2O=2Al(OH)3↓+3CO2↑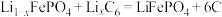 。一种以废旧磷酸铁锂电池正极片(含
。一种以废旧磷酸铁锂电池正极片(含 导电石墨、铝箔)为原料制备微溶于水的Li3PO4,的工艺流程如图,下列说法错误的是
导电石墨、铝箔)为原料制备微溶于水的Li3PO4,的工艺流程如图,下列说法错误的是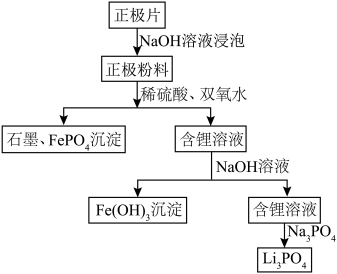
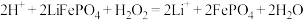
 后,可以通过过滤、冷水洗涤、干燥等操作获得较纯净的
后,可以通过过滤、冷水洗涤、干燥等操作获得较纯净的
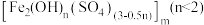 是新型絮凝剂,其中
是新型絮凝剂,其中 显
显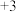 价
价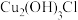 的过程是非氧化还原过程
的过程是非氧化还原过程

