已知锌与浓硫酸反应生成SO2,与稀硫酸反应生成H2。
I.39g的锌与50mL18.4mol/L的浓硫酸完分反应,锌完全溶解,同时收集到标准状况下气体VL,将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08mol/L。
(1)反应过程中消耗H2SO4的物质的量是___________ 。
(2)气体的成分是___________ ,V=___________ 。
II.已知:SO2+I2+2H2O= +2I-+4H+。
+2I-+4H+。
(3)现将101.6mgI2固体溶于水配成400mL溶液,(为了便于观察,可以加几滴淀粉)用于吸收空气管道中的SO2,若管道中空气流量为40L/min,经过5min溶液恰好褪色,请计算:空气样品中SO2的含量为___________ mg/L。
I.39g的锌与50mL18.4mol/L的浓硫酸完分反应,锌完全溶解,同时收集到标准状况下气体VL,将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08mol/L。
(1)反应过程中消耗H2SO4的物质的量是
(2)气体的成分是
II.已知:SO2+I2+2H2O=
 +2I-+4H+。
+2I-+4H+。(3)现将101.6mgI2固体溶于水配成400mL溶液,(为了便于观察,可以加几滴淀粉)用于吸收空气管道中的SO2,若管道中空气流量为40L/min,经过5min溶液恰好褪色,请计算:空气样品中SO2的含量为
更新时间:2024-03-05 11:07:45
|
相似题推荐
计算题
|
较难
(0.4)
解题方法
【推荐1】工业上常用废铁屑溶于一定浓度的硫酸溶液制备绿矾( FeSO4·7H2O )。
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:____ 。
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为_____ 。
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与VmL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为______________________ ;
②若V=35,试计算混合物中CuS的质量分数________________
(1)若用98% 1.84 g/cm3的浓硫酸配制生产用28%的硫酸溶液,则浓硫酸与水的体积比约为1:
(2)为测定某久置于空气的绿矾样品中Fe2+的氧化率,某同学设计如下实验:取一定量的样品溶于足量的稀硫酸中,然后加入5.00 g铁粉充分反应,收集到224 mL(标准状况)气体,剩余固体质量为3.88 g,测得反应后的溶液中Fe2+的物质的量为0.14 mol(不含Fe3+)。则该样品中Fe2+离子的氧化率为
(3)硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O](俗称莫尔盐),较绿矾稳定,在氧化还原滴定分析中常用来配制Fe2+的标准溶液。现取0.4 g Cu2S和CuS的混合物在酸性溶液中用40 mL 0.150 mol/L KMnO4溶液处理,发生反应如下:
8MnO4-+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
6MnO4-+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与VmL 0.2 mol/L (NH4)2Fe(SO4)2溶液完全反应。已知:MnO4-+Fe2++H+——Mn2++Fe3++H2O(未配平)
①V的取值范围为
②若V=35,试计算混合物中CuS的质量分数
您最近一年使用:0次
计算题
|
较难
(0.4)
解题方法
【推荐2】(1)某KClO3和KCl的混合物,钾的质量分数为43.09%,则氧的质量分数为_______ %(保留2位小数)。
(2)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
①若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为_____ g(保留2位小数)。
②若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为__________ ;原混合物中KClO3的质量为__________ g;所得KCl溶液的密度为1.72g/cm3,则溶液的物质的量浓度为______ mol/L(保留2位小数)。
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):
I2+2KClO3→2KIO3+Cl2 ① KIO3+Cl2+3KOH →K2H3IO6+2KCl ②
最终制得的KIO3和K2H3IO6 的物质的量之比x,若制得100molK2H3IO6, 共消耗ymol KClO3,试确定y与x的关系式_______________ 。
(4)取研细的KClO3、I2各0.02mol置于锥形瓶中,在不断摇动的情况下,慢慢加入浓盐酸,直到I2完全消失,没有黄绿色气体产生。将锥形瓶置于冰水中,有橙红色晶体A析出,剩余溶液中只检出K+和Cl-。取少量A放入试管中,发现A在常温下就会有升华现象。若将A水浴加热,产生红棕色液体B和黄绿色气体。
①试确定A的化学式。__________
②能否确定B的化学式?说明理由。__________
(2)取KClO3和MnO2的混合物16.60g加热至恒重,将反应后的固体加15g水充分溶解,剩余固体6.55g (25℃),再加5 g水充分溶解,仍剩余固体4.80g(25℃)。
①若剩余的4.80g固体全是MnO2,则原混合物中KClO3的质量为
②若剩余的4.80g固体是MnO2和KCl的混合物,则25℃时KCl的溶解度为
(3)可用以下反应制备KIO3和K2H3IO6(高碘酸氢二钾):
I2+2KClO3→2KIO3+Cl2 ① KIO3+Cl2+3KOH →K2H3IO6+2KCl ②
最终制得的KIO3和K2H3IO6 的物质的量之比x,若制得100molK2H3IO6, 共消耗ymol KClO3,试确定y与x的关系式
(4)取研细的KClO3、I2各0.02mol置于锥形瓶中,在不断摇动的情况下,慢慢加入浓盐酸,直到I2完全消失,没有黄绿色气体产生。将锥形瓶置于冰水中,有橙红色晶体A析出,剩余溶液中只检出K+和Cl-。取少量A放入试管中,发现A在常温下就会有升华现象。若将A水浴加热,产生红棕色液体B和黄绿色气体。
①试确定A的化学式。
②能否确定B的化学式?说明理由。
您最近一年使用:0次
【推荐1】(1)某同学进行CO2与Na2O2反应的探究实验,将100 mL纯净的CO2通过一定量的Na2O2粉末,反应后气体体积为65 mL,则反应消耗CO2的体积是__________ mL。
(2)已知铜和浓硫酸可以在加热条件下发生反应:Cu + H2SO4(浓) →CuSO4 + SO2↑ +H2O(方程式未配平),如果一定量的铜片与100mL 18mol/L的浓H2SO4充分反应,在反应过程中转移了0.2mol电子,将反应后所得到的溶液(不考虑SO2的溶解)经一定稀释后与足量Ba(OH)2溶液充分反应。计算反应后所得沉淀的质量为__________ g(保留到0.1g)。
(3)现有 NaOH 和 Ba(OH)2 混合溶液 100mL,已知该溶液中 c(OH-)=1mol/L,向溶液中缓缓通入CO2气体(溶液体积变化忽略不计)),当至少通入CO2气体体积为 0.56L(标准状况)时生成的沉淀最多,那么当通入CO2气体体积为1.792 L(标况)时,溶液中HCO 的物质的量浓度是
的物质的量浓度是______ mol/L。
(2)已知铜和浓硫酸可以在加热条件下发生反应:Cu + H2SO4(浓) →CuSO4 + SO2↑ +H2O(方程式未配平),如果一定量的铜片与100mL 18mol/L的浓H2SO4充分反应,在反应过程中转移了0.2mol电子,将反应后所得到的溶液(不考虑SO2的溶解)经一定稀释后与足量Ba(OH)2溶液充分反应。计算反应后所得沉淀的质量为
(3)现有 NaOH 和 Ba(OH)2 混合溶液 100mL,已知该溶液中 c(OH-)=1mol/L,向溶液中缓缓通入CO2气体(溶液体积变化忽略不计)),当至少通入CO2气体体积为 0.56L(标准状况)时生成的沉淀最多,那么当通入CO2气体体积为1.792 L(标况)时,溶液中HCO
 的物质的量浓度是
的物质的量浓度是
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐2】将一定质量的锌粒投入100mL 18.5mol/L的浓硫酸中,待锌粒完全溶解后,测得生成的H2和SO2共33.6L(标准状况),此时溶液中尚余0.1mol H+.计算可知:
(1)投入锌粒的质量为_____ g.
(2)生成的H2和SO2的物质的量之比为_____ .
(1)投入锌粒的质量为
(2)生成的H2和SO2的物质的量之比为
您最近一年使用:0次
计算题
|
较难
(0.4)
名校
【推荐1】铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料,已知Pb的化合价只有0、+2、+4,回答下列问题:
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为_____ 。
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为_____ 。
(1)PbO2和PbO的混合物中,Pb和O的物质的量之比为8:11,则混合物中,PbO2和PbO的物质的量之比为
(2)用足量的CO还原13.7g某铅氧化物,把生成的CO2全部通入到过量的澄清石灰水中,得到的沉淀干燥后质量为8.0g,则此铅氧化物的化学式可表示为
您最近一年使用:0次
【推荐2】硫铁矿石(主要成分FeS2)用于工业制硫酸,其排出的矿渣在一定条件下以磁性铁为主。经磁选获得精矿,可直接用于高炉炼铁。已知某精矿的主要成分是磁性铁(Fe3O4)和Fe2O3及杂质(杂质不含铁、硫、氧元素,且杂质不耗氧)。请回答下列问题:
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁的质量分数是:_______ (用小数表示,保留3位小数)。
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4%的生铁_______ 吨。
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n(Fe)∶n(O)=5∶7,则富氧空气中O2和N2的体积比为_______ 。
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比_______ (最简单的整数比)。
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
则该硫酸溶液的物质的量浓度_______ 。
③若在实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (写出必要的步骤,答案保留3位小数)_______ 。
(1)某硫铁矿石中(杂质不含铁、硫)含硫的质量分数是0.360,则该硫铁矿石中含铁的质量分数是:
(2)如用上述硫铁矿石制硫酸,矿渣经磁选获得精矿,直接用于高炉炼铁,当制得98%的硫酸1.92吨时(不考虑硫的损失),则炼铁厂(不计选矿及炼铁时铁的损耗)最多可生产含碳4%的生铁
(3)煅烧硫铁矿常用富氧空气。从沸腾炉排出的气体成分如下表。如果精矿中铁、氧的物质的量之比为n(Fe)∶n(O)=5∶7,则富氧空气中O2和N2的体积比为
| 气体 | SO2 | N2 | O2 |
| 物质的量(mol) | 10 | 58 | 6 |
(4)炼铁厂生产的生铁常用于炼钢。取某钢样粉末28.12 g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224 mL(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比
②再取三份不同质量的钢样粉末分别加到100 mL相同浓度的H2SO4溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | I | II | III |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
则该硫酸溶液的物质的量浓度
③若在实验II中继续加入m g钢样粉末,计算反应结束后剩余的固体质量为多少? (写出必要的步骤,答案保留3位小数)
您最近一年使用:0次
【推荐3】回答下列问题:
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为___ 。
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为___ 。
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式___ 。
(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为___ 。
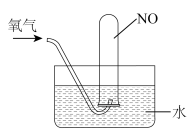
(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为___ 。
(1)将等质量的镁分别与足量的CO2、O2、N2、空气中充分燃烧,反应前后固体增重由大到小的顺序为
(2)在常温下,实验室用固体亚硫酸钠和中等浓度的硫酸制取SO2气体。将制得的SO2气体通入紫色石蕊试液,可观察到的现象为
(3)在常温下,把NO气体压缩到1.01×108Pa,在一个体积固定的容器里加热到50℃,发现气体的压力迅速下降,压力降至略小于原压力
 就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式
就不再改变,已知其中一种产物为N2O,写出上述变化的化学方程式(4)按如图进行实验,试管中装有NO,然后缓慢地通入84mLO2,充分反应后液面高度不变,则原试管中装有NO的体积为

(5)标况下,将一定体积的盛满NO、NO2、O2的混合气体的试管倒立于水槽中,水充满整个试管,则试管内的溶液的物质的量浓度范围是(假定试管内溶液不扩散)为
您最近一年使用:0次




