解题方法
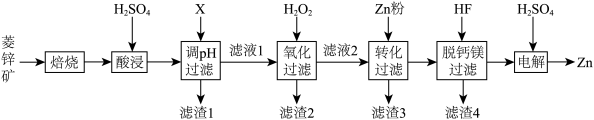
1 . 以菱锌矿(主要含有ZnCO3,另含有少量CaO、Fe2O3、FeO、CoO、CuO、SiO2等)为原料电解制Zn的流程如图:
(1)“酸浸”时为提高锌的浸出率,可采取的措施有___________ (写出一种即可)。
(2)“调pH过滤”中,物质X最适宜选择___________ (填标号)。
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为___________ 。若反应结束时,溶液pH为5,则残留的c(Fe3+)=___________ mol·L-l。
(4)H2O2是常见绿色氧化剂,原因是___________ 。
(5)“脱钙镁过滤”后,溶液中 =
=___________ 。
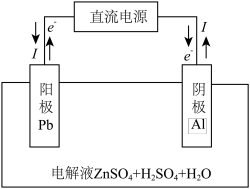
(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为___________ 。
| 物质 | Fe(OH)3 | Zn(OH)2 | MgF2 | CaF2 |
| Ksp | 2.7×10-39 | 1.3×10-17 | 5.2×10-11 | 3.9×10-9 |
(1)“酸浸”时为提高锌的浸出率,可采取的措施有
(2)“调pH过滤”中,物质X最适宜选择
A.NaOH B.Ca(OH)2 C.NH3·H2O
(3)“氧化过滤”中,Fe2+转化为Fe(OH)3沉淀的离子方程式为
(4)H2O2是常见绿色氧化剂,原因是
(5)“脱钙镁过滤”后,溶液中
 =
=(6)“电解”装置示意如图,开始通电后,阳极表面生成PbO2,保护阳极不被酸性电解液腐蚀,相应的电极反应式为
您最近一年使用:0次
解题方法
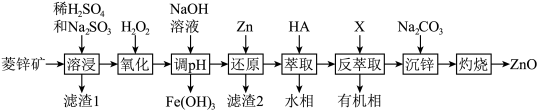
2 . ZnO是一种难溶于水的白色固体,在化学工业中主要用作橡胶和颜料的添加剂,医药上用于制软膏、橡皮膏等。工业上由菱锌矿(主要成分为ZnCO3、ZnO,还含有少量Ni2O3、FeO、MgCO3、PbO2等杂质)制备ZnO的工艺流程如图所示:
②“溶浸”后的溶液所含金属离子主要有:Zn2+、Fe2+、Ni2+、Mg2+;
③氧化性顺序:Ni2+>Zn2+。
回答下列问题:
(1)基态Zn原子核外电子排布式为___________ 。
(2)滤渣1的化学式是___________ ,“溶浸”过程中Ni2O3发生反应的离子方程式是___________ 。
(3)已知“氧化”后溶液中c(Zn2+)=1.2mol·L-1,“调pH”的pH范围是___________ (保留两位有效数字)。(已知:溶液中离子浓度小于等于10-5mol·L-1时,认为该离子沉淀完全。)“还原”时加入锌粉的目的是___________ 。
(4)有机萃取剂HA与ZnSO4反应的化学方程式为2HA+ZnSO4 ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是
ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是___________ 。
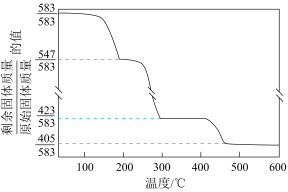
(5)在“沉锌”与“灼烧”之间进行的操作是___________ ,“沉锌”得到碱式碳酸锌[化学式为2ZnCO3·3Zn(OH)2·2H2O],碱式碳酸锌升温过程中固体的质量变化如图所示。350℃时,剩余固体中已不含碳元素,则剩余固体的成分是___________ (填化学式)。
②“溶浸”后的溶液所含金属离子主要有:Zn2+、Fe2+、Ni2+、Mg2+;
③氧化性顺序:Ni2+>Zn2+。
回答下列问题:
(1)基态Zn原子核外电子排布式为
(2)滤渣1的化学式是
(3)已知“氧化”后溶液中c(Zn2+)=1.2mol·L-1,“调pH”的pH范围是
(4)有机萃取剂HA与ZnSO4反应的化学方程式为2HA+ZnSO4
 ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是
ZnA2+H2SO4,则“反萃取”时加入试剂X的化学式是(5)在“沉锌”与“灼烧”之间进行的操作是
您最近一年使用:0次
解题方法
3 . 某湿法炼锌的萃余液中含有 、
、 、
、 、
、 、
、 、
、 及30~60
及30~60
 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
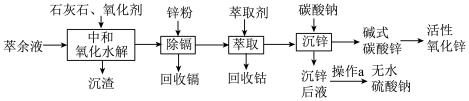
已知:
回答下列问题:
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的 ;再加入石灰石调节溶液的pH为4.0。
;再加入石灰石调节溶液的pH为4.0。
①“氧化”时, 转化为
转化为 除去,反应的离子方程式为
除去,反应的离子方程式为________ ,为提高反应速率可采取的措施_______ (举1例)。
②“沉渣”的主要成分除 、
、 外还有
外还有______ 。
③“氧化”时,若加入过量的 ,钴元素将会进入“沉渣”中,则氧化水解后的溶液中含钴微粒浓度为
,钴元素将会进入“沉渣”中,则氧化水解后的溶液中含钴微粒浓度为______  。
。
(2)“除镉”时,主要反应的离子方程式为________ 。
(3)“沉锌”时,在近中性条件下加入 可得碱式碳酸锌[
可得碱式碳酸锌[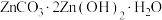 ]固体,同时产生大量的气体。
]固体,同时产生大量的气体。
①产生大量气体的原因是________ 。
② 需洗涤,检验是否洗净的试剂是
需洗涤,检验是否洗净的试剂是________ 。
(4)不同质量分数的 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含20%
晶体的物种如图所示。欲从含20%  及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”步骤为
,“操作a”步骤为________ 。

 、
、 、
、 、
、 、
、 、
、 及30~60
及30~60
 等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:
已知:
| 沉淀物 |  |  |  |  |  |
 | 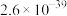 |  | 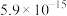 |  | 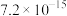 |
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;加入一定量的
 ;再加入石灰石调节溶液的pH为4.0。
;再加入石灰石调节溶液的pH为4.0。①“氧化”时,
 转化为
转化为 除去,反应的离子方程式为
除去,反应的离子方程式为②“沉渣”的主要成分除
 、
、 外还有
外还有③“氧化”时,若加入过量的
 ,钴元素将会进入“沉渣”中,则氧化水解后的溶液中含钴微粒浓度为
,钴元素将会进入“沉渣”中,则氧化水解后的溶液中含钴微粒浓度为 。
。(2)“除镉”时,主要反应的离子方程式为
(3)“沉锌”时,在近中性条件下加入
 可得碱式碳酸锌[
可得碱式碳酸锌[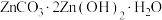 ]固体,同时产生大量的气体。
]固体,同时产生大量的气体。①产生大量气体的原因是
②
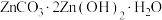 需洗涤,检验是否洗净的试剂是
需洗涤,检验是否洗净的试剂是(4)不同质量分数的
 溶液在不同温度下析出
溶液在不同温度下析出 晶体的物种如图所示。欲从含20%
晶体的物种如图所示。欲从含20%  及微量杂质的“沉锌后液”中直接析出无水
及微量杂质的“沉锌后液”中直接析出无水 ,“操作a”步骤为
,“操作a”步骤为
您最近一年使用:0次
名校
4 . 活性氧化锌(ZnO)常用于医药、涂料、陶瓷等。某科研小组以锌废料(主要成分是ZnSO4和ZnO,含少量的Fe、Cu、Pb、As等元素以及油污)为原料制备活性氧化锌及回收其他金属元素,流程如图。
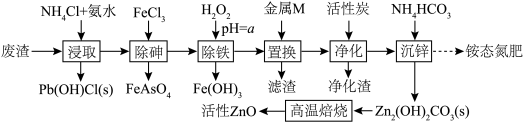
已知几种金属离子生成氢氧化物的pH如下表:
回答下列问题:
(1)As的原子结构示意图为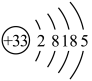 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为______ 价。
(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是______ 。
(3)a的范围为______ 。“除铁”时发生氧化还原反应的离子方程式为______ 。
(4)金属M的化学式为______ 。
(5)“沉锌”的滤液采用______ 、______ ,过滤、洗涤、干燥等一系列操作,得到铵态氮肥。
(6)“高温焙烧”过程中发生反应的化学方程式为______ 。

已知几种金属离子生成氢氧化物的pH如下表:
| 金属离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe3+ | 1.5 | 3.7 |
| Zn2+ | 7.9 | 10.0 |
| Fe2+ | 6.3 | 9.7 |
| Cu2+ | 7.4 | 9.4 |
(1)As的原子结构示意图为
 。FeAsO4中铁的化合价为
。FeAsO4中铁的化合价为(2)“浸取”中,适当加热能提高浸取速率,但是温度过高,浸取速率反而降低,其主要原因是
(3)a的范围为
(4)金属M的化学式为
(5)“沉锌”的滤液采用
(6)“高温焙烧”过程中发生反应的化学方程式为
您最近一年使用:0次
2024-03-29更新
|
122次组卷
|
2卷引用:2024届西藏自治区拉萨市高三上学期第一次模拟考试理综试题
名校
解题方法
5 . 利用化工厂产生的烟灰(ZnO的质量分数为ω,还含有少量CuO、MnO2、FeO等杂质)制备活性ZnO的工艺流程如图。下列说法错误的是
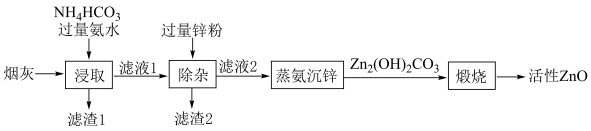
| A.由滤液1中的阳离子主要含有[Zn(NH3)4]2+、[Cu(NH3)4]2+、NH4+可知,滤渣1中含有FeO 和MnO2 |
| B.“除杂”工序反应的离子方程式:Zn+[Cu(NH3)4]2+ =Cu + [Zn(NH3)4]2+ |
| C.“蒸氨沉锌”、“煅烧”时产生的气体可返回到“浸取”工序中循环使用 |
D.从m kg烟灰中得到活性ZnO a kg,则ZnO 的回收率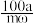 % % |
您最近一年使用:0次
2024-03-22更新
|
943次组卷
|
5卷引用:东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷
东北三省三校(哈师大附中、东北师大附中、辽宁省实验中学)2023-2024学年高三下学期第一次联合模拟考化学试卷2024届吉林省通化市梅河口市第五中学高三下学期一模化学试题湖南省长沙市湖南师范大学附属中学2023-2024学年高二下学期第一次大练习化学试题(已下线)化学(辽宁卷01)-2024年高考押题预测卷(已下线)压轴题01?离子方程式与离子共存的判断(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
6 . 以炼铁厂锌灰(主要成分为ZnO,含少量的CuO、SiO2、Fe2O3)为原料制备ZnO的流程如图所示。下列说法正确的是
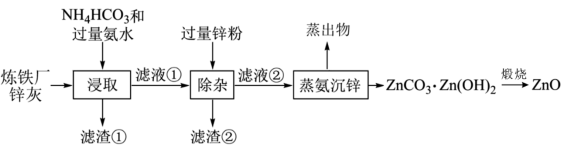
| A.H-N-H键角:[Cu(NH3)4]2+<NH3 |
| B.“滤渣②”的主要成分为Fe、Cu和Zn |
| C.所含金属元素的质量“滤液①”<“滤液②” |
| D.“煅烧”时需要在隔绝空气条件下进行 |
您最近一年使用:0次
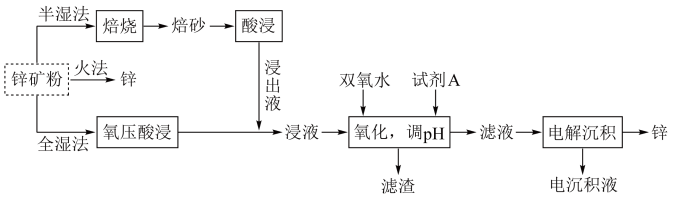
7 . 锌及锌合金(如黄铜、白口铁等)广泛用于生产、生活。某小组拟以锌矿(主要成分是ZnS,含少量FeS等杂质)为原料采用多种方法冶炼锌的流程如下: 是两性氢氧化物,易溶于
是两性氢氧化物,易溶于 溶液,也溶于氨水,能发生相关反应:
溶液,也溶于氨水,能发生相关反应: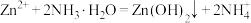 ,
,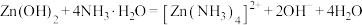 。
。
(1)已知 (结构如图所示)中
(结构如图所示)中 采用
采用 杂化,由此推知:
杂化,由此推知: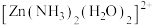 有
有___________ 种结构。NH3分子中键角为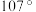 ,与
,与 中配体
中配体 键角不同的原因是
键角不同的原因是___________ 。 ,倭铅即指
,倭铅即指 )。由此可知,古代炼锌方法类似上述三种方法中
)。由此可知,古代炼锌方法类似上述三种方法中___________ (填字母,下同)。
a.半湿法 b.火法 c.全湿法
上述三种方法中,最佳方法是___________ 。
(3)“氧压酸浸”即在一定浓度稀硫酸中加入锌矿粉,并在加压下通入 ,除生成
,除生成 外,还能回收非金属单质。写出主要反应的离子方程式:
外,还能回收非金属单质。写出主要反应的离子方程式:___________ 。
(4)若将“氧化、调 ”步骤改为直接用过量的
”步骤改为直接用过量的 或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,
或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,___________ (填“是”或“否”),请说明原因:___________ 。
(5)“电解沉积”(以惰性材料为电极)中阳极反应式为___________ 。航母外壳常镶嵌一些锌块,这种保护航母的电化学方法叫___________ 。
 是两性氢氧化物,易溶于
是两性氢氧化物,易溶于 溶液,也溶于氨水,能发生相关反应:
溶液,也溶于氨水,能发生相关反应: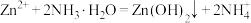 ,
,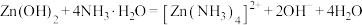 。
。(1)已知
 (结构如图所示)中
(结构如图所示)中 采用
采用 杂化,由此推知:
杂化,由此推知: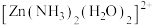 有
有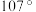 ,与
,与 中配体
中配体 键角不同的原因是
键角不同的原因是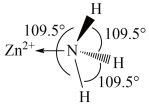
 ,倭铅即指
,倭铅即指 )。由此可知,古代炼锌方法类似上述三种方法中
)。由此可知,古代炼锌方法类似上述三种方法中a.半湿法 b.火法 c.全湿法
上述三种方法中,最佳方法是
(3)“氧压酸浸”即在一定浓度稀硫酸中加入锌矿粉,并在加压下通入
 ,除生成
,除生成 外,还能回收非金属单质。写出主要反应的离子方程式:
外,还能回收非金属单质。写出主要反应的离子方程式:(4)若将“氧化、调
 ”步骤改为直接用过量的
”步骤改为直接用过量的 或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,
或氨水进行除杂,该操作是否会对“电解沉积”过程造成影响,(5)“电解沉积”(以惰性材料为电极)中阳极反应式为
您最近一年使用:0次
名校
8 . 以重晶石(BaSO4)为原料生产白色颜料立德粉(ZnS和BaSO4混合物)的工艺流程如图所示:
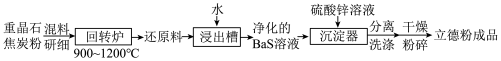
| A.混料研细的目的是加快回转炉中的反应速率 |
| B.回转炉中每生成1molBaS,有4mole-发生转移 |
| C.浸出槽的滤渣经处理后循环利用,可提高原料利用率 |
D.沉淀器中发生的反应为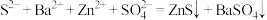 |
您最近一年使用:0次
2024-03-18更新
|
82次组卷
|
2卷引用:河南省名校联盟2023-2024学年高三上学期12月月考化学试题
9 . H2S是一种大气污染物。工业尾气中含有H2S,会造成严重的环境污染;未脱除H2S的煤气,运输过程中还会腐蚀管道。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。____________ (填序号)。
a.单质硫为黄色固体
b.脱硫反应为
c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是_____________ 。
(2)电化学溶解—沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。
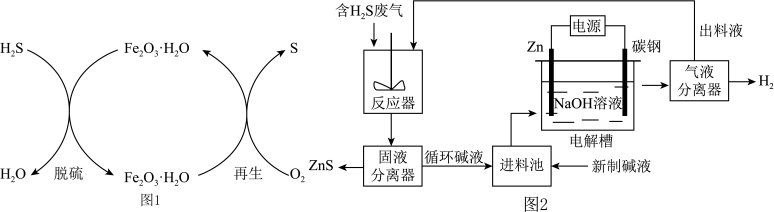
已知:Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以 形式存在。
形式存在。
①锌棒连接直流电源的___________ (填“正极”或“负极”)。
②反应器中反应的离子方程式为_________ 。
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:________ 。
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ⅱ.将带有沉淀的滤纸加入盛有15mL0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10min后,用少量水冲洗瓶壁和瓶塞。(已知: )
)
ⅲ.用0.1mol/LNa2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知: )
)
①滴定终点的现象是_______ 。
②若消耗Na2S2O3标准液的体积为20mL,则煤气中H2S的含量为_______ mg/m3。
(1)干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。
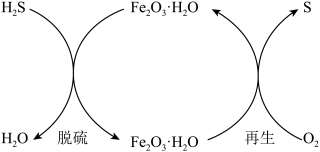
a.单质硫为黄色固体
b.脱硫反应为

c.再生过程中,硫元素被还原
d.脱硫过程中,增大反应物的接触面积可提高脱硫效率
②从安全环保的角度考虑,再生过程需控制反应温度不能过高的原因是
(2)电化学溶解—沉淀法是一种回收利用H2S的新方法,其工艺原理如下图所示。

已知:Zn与强酸、强碱都能反应生成H2;Zn(II)在过量的强碱溶液中以
 形式存在。
形式存在。①锌棒连接直流电源的
②反应器中反应的离子方程式为
③电解槽中,没接通电源时已经有H2产生,用化学用语解释原因:
(3)常用碘量法测定煤气中H2S的含量,其实验过程如下:
i.将10L煤气通入盛有100mL锌氨络合液的洗气瓶中,将其中的H2S全部转化为ZnS沉淀,过滤;
ⅱ.将带有沉淀的滤纸加入盛有15mL0.1mol/L碘标准液、200mL水和10mL盐酸的碘量瓶中,盖上瓶塞,摇动碘量瓶至瓶内滤纸摇碎,置于暗处反应10min后,用少量水冲洗瓶壁和瓶塞。(已知:
 )
)ⅲ.用0.1mol/LNa2S2O3标准液滴定,待溶液呈淡黄色时,加入1mL淀粉指示剂,继续滴定至终点。(已知:
 )
)①滴定终点的现象是
②若消耗Na2S2O3标准液的体积为20mL,则煤气中H2S的含量为
您最近一年使用:0次
10 . 已知锌与浓硫酸反应生成SO2,与稀硫酸反应生成H2。
I.39g的锌与50mL18.4mol/L的浓硫酸完分反应,锌完全溶解,同时收集到标准状况下气体VL,将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08mol/L。
(1)反应过程中消耗H2SO4的物质的量是___________ 。
(2)气体的成分是___________ ,V=___________ 。
II.已知:SO2+I2+2H2O= +2I-+4H+。
+2I-+4H+。
(3)现将101.6mgI2固体溶于水配成400mL溶液,(为了便于观察,可以加几滴淀粉)用于吸收空气管道中的SO2,若管道中空气流量为40L/min,经过5min溶液恰好褪色,请计算:空气样品中SO2的含量为___________ mg/L。
I.39g的锌与50mL18.4mol/L的浓硫酸完分反应,锌完全溶解,同时收集到标准状况下气体VL,将反应后的溶液稀释到500mL,测得溶液中氢离子的浓度为0.08mol/L。
(1)反应过程中消耗H2SO4的物质的量是
(2)气体的成分是
II.已知:SO2+I2+2H2O=
 +2I-+4H+。
+2I-+4H+。(3)现将101.6mgI2固体溶于水配成400mL溶液,(为了便于观察,可以加几滴淀粉)用于吸收空气管道中的SO2,若管道中空气流量为40L/min,经过5min溶液恰好褪色,请计算:空气样品中SO2的含量为
您最近一年使用:0次



