名校
解题方法
1 . 纳米磁性Fe3O4在生物靶向材料、微波吸收材料及静电复印显影剂等方面都有极其广泛的用途。一种利用废旧镀锌铁皮制备纳米的工艺流程如下:
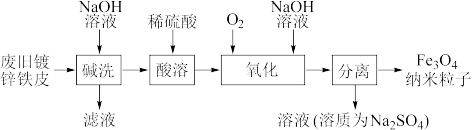
(1)将废旧镀锌铁皮“碱洗”的目的是除油污和___________ 。
(2)“酸溶”后的溶液中阳离子主要有___________ 。
(3)“氧化”时发生的总反应化学方程式为___________ 。在酸性条件下,FeSO4很容易发生如下反应: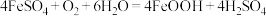 ,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为___________ 。
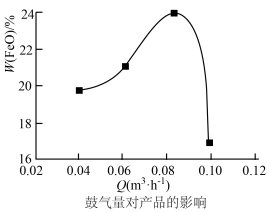
(4)空气的流量影响磁性性能的好坏。由图可知,当空气的鼓入量为0.08m3·h-1时,磁性Fe3O4会混有FeO(纵坐标w为质量分数)。此时实际产品中Fe2+与Fe3+的物质的量之比约为___________ 。
(5)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是___________ 。

(1)将废旧镀锌铁皮“碱洗”的目的是除油污和
(2)“酸溶”后的溶液中阳离子主要有
(3)“氧化”时发生的总反应化学方程式为
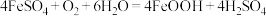 ,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为
,为避免生成FeOOH影响产品纯度,则“氧化”时应选择的加料方式为(4)空气的流量影响磁性性能的好坏。由图可知,当空气的鼓入量为0.08m3·h-1时,磁性Fe3O4会混有FeO(纵坐标w为质量分数)。此时实际产品中Fe2+与Fe3+的物质的量之比约为

(5)用激光笔照射“氧化”过程中所得分散系,可观察到的实验现象是
您最近一年使用:0次
2 . Ⅰ.氯化钒(VCl2)有强还原性和吸湿性,熔点为425℃、沸点为900℃,是制备多种医药、催化剂、含钒化合物的中间体。学习小组在实验室制备VCl2并进行相关探究。回答下列问题:
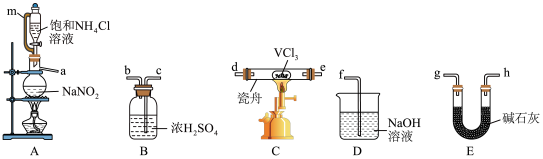
(1)小组同学通过VCl3分解制备VCl2,并检验气体产物。
①按气流方向,上述装置合理连接顺序为:________
a→(____)→(____)→(____)→(____)→(____)→(____)→(____)(用小写字母填空)。
②A中生成N2,该反应的离子方程式为___________ ,制备该气体作用为___________ 。
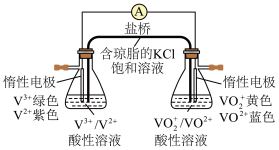
(2)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,则VO 、V2+的还原性较强的是
、V2+的还原性较强的是___________ 。
Ⅱ.某科学小组利用工业锌渣(主要成分是ZnO、还含有少量的PbO、FeO、Fe2O3、CuO、MnO、SiO2)制取活性ZnO的工艺流程如下图所示:
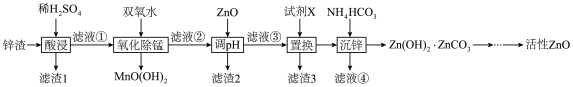
请回答下列问题:
(3)为了提高锌渣的浸出率,可采取的措施有___________ (列举一点)。
(4)滤渣1的主要成分有___________ 和___________ (填化学式);试剂X是___________ (填化学式)。
(5)写出生成MnO(OH)2的离子方程式:___________ 。
(6)为了检验滤液②中是否含有Fe2+,可选用的试剂是___________ 。
(7)检验Zn(OH)2·ZnCO3洗涤干净的操作方法为___________ 。

(1)小组同学通过VCl3分解制备VCl2,并检验气体产物。
①按气流方向,上述装置合理连接顺序为:
a→(____)→(____)→(____)→(____)→(____)→(____)→(____)(用小写字母填空)。
②A中生成N2,该反应的离子方程式为
(2)小组同学进一步用如图所示装置比较含钒离子的还原性。接通电路后,观察到右侧锥形瓶中溶液蓝色逐渐变深,则VO
 、V2+的还原性较强的是
、V2+的还原性较强的是
Ⅱ.某科学小组利用工业锌渣(主要成分是ZnO、还含有少量的PbO、FeO、Fe2O3、CuO、MnO、SiO2)制取活性ZnO的工艺流程如下图所示:

请回答下列问题:
(3)为了提高锌渣的浸出率,可采取的措施有
(4)滤渣1的主要成分有
(5)写出生成MnO(OH)2的离子方程式:
(6)为了检验滤液②中是否含有Fe2+,可选用的试剂是
(7)检验Zn(OH)2·ZnCO3洗涤干净的操作方法为
您最近一年使用:0次
名校
解题方法
3 . 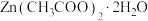 常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为
常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的
,含少量的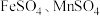 )为原料制备
)为原料制备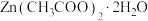 的实验流程如图所示:
的实验流程如图所示:
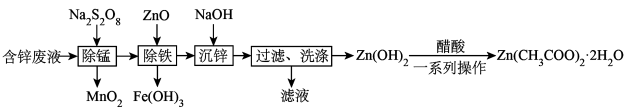
请回答下列问题:
(1)已知 中存在一个过氧键
中存在一个过氧键 ,则过二硫酸钠
,则过二硫酸钠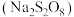 中
中 元素的化合价为
元素的化合价为_____________ ;“除锰”阶段被氧化的元素有_____________ (填元素名称)。
(2)加入 能“除铁”的原因:
能“除铁”的原因: 消耗
消耗 使溶液
使溶液 调整至
调整至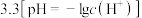 左右时,能使溶液中的
左右时,能使溶液中的 完全转化为
完全转化为 沉淀,则该阶段发生总反应的离子方程式为
沉淀,则该阶段发生总反应的离子方程式为_________ 。
(3)“沉锌”过程中通常加入 。
。
① 在水溶液中的电离方程式为
在水溶液中的电离方程式为_____________________ 。
②向饱和食盐水中加入与 等物质的量的
等物质的量的 ,固体时发生反应的化学方程式为
,固体时发生反应的化学方程式为_____________________________________________________________________________ 。
(4)
_____________ (填“属于”或“不属于”)盐,其与醋酸反应生成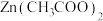 的离子方程式为
的离子方程式为_____________________________________________________ 。
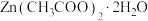 常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为
常用作测定钠、蛋白的试剂、色谱分析试剂等,易溶于水。实验室以含锌废液(主要成分为 ,含少量的
,含少量的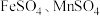 )为原料制备
)为原料制备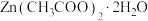 的实验流程如图所示:
的实验流程如图所示:
请回答下列问题:
(1)已知
 中存在一个过氧键
中存在一个过氧键 ,则过二硫酸钠
,则过二硫酸钠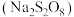 中
中 元素的化合价为
元素的化合价为(2)加入
 能“除铁”的原因:
能“除铁”的原因: 消耗
消耗 使溶液
使溶液 调整至
调整至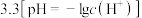 左右时,能使溶液中的
左右时,能使溶液中的 完全转化为
完全转化为 沉淀,则该阶段发生总反应的离子方程式为
沉淀,则该阶段发生总反应的离子方程式为(3)“沉锌”过程中通常加入
 。
。①
 在水溶液中的电离方程式为
在水溶液中的电离方程式为②向饱和食盐水中加入与
 等物质的量的
等物质的量的 ,固体时发生反应的化学方程式为
,固体时发生反应的化学方程式为(4)

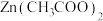 的离子方程式为
的离子方程式为
您最近一年使用:0次
2024-02-17更新
|
287次组卷
|
2卷引用:安徽省合肥市第六中学2023-2024学年高一上学期期末检测化学试题
名校
4 . 锌焙砂是锌精矿经焙烧后所得的产物,是褐色微颗粒状固体,其主要成分为 ,还含有
,还含有 、
、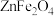 和少量
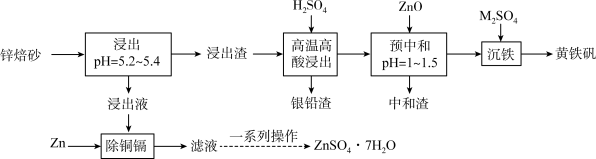
和少量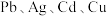 ,以锌焙砂为原料制备
,以锌焙砂为原料制备 和黄铁矾的工艺流程如下:
和黄铁矾的工艺流程如下:
已知:①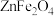 可以看成
可以看成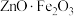 ,在高温高酸环境下才会溶解;
,在高温高酸环境下才会溶解;
② 下,
下, 和
和 开始沉淀和沉淀完全(
开始沉淀和沉淀完全(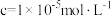 )时的
)时的 如下表:
如下表:
回答下列问题:
(1)基态 原子的简化电子排布式为
原子的简化电子排布式为_______ ,基态 原子价层电子轨道表示式为
原子价层电子轨道表示式为_______ ,基态 原子未成对电子数目为
原子未成对电子数目为_______ ,铜元素的焰色为绿色,该光谱属于_______ (填“发射”或“吸收”)光谱。
(2)欲提高 在5.2~5.4时的“浸出”速率,可采用的方法是
在5.2~5.4时的“浸出”速率,可采用的方法是_______ (写两种)。
(3)在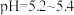 “浸出”时,锌焙砂中的铜转化为
“浸出”时,锌焙砂中的铜转化为 反应的离子方程式为
反应的离子方程式为_______ 。
(4) 时,浸出液中
时,浸出液中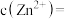
_______  。
。
(5)当有 、
、 或
或 存在时,调节含
存在时,调节含 溶液的
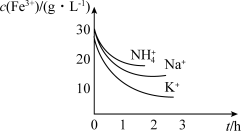
溶液的 ,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,
,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,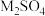 最好选用
最好选用_______ (填化学式)。
(6)获得 的一系列操作是
的一系列操作是_______ 、_______ 过滤、洗涤、干燥。
 ,还含有
,还含有 、
、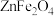 和少量
和少量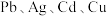 ,以锌焙砂为原料制备
,以锌焙砂为原料制备 和黄铁矾的工艺流程如下:
和黄铁矾的工艺流程如下:
已知:①
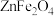 可以看成
可以看成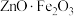 ,在高温高酸环境下才会溶解;
,在高温高酸环境下才会溶解;②
 下,
下, 和
和 开始沉淀和沉淀完全(
开始沉淀和沉淀完全(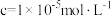 )时的
)时的 如下表:
如下表:| 金属离子 |  | |
| 开始沉淀 | 沉淀完全 | |
 | 6.2 | 8.2 |
 | 1.5 | 3.2 |
(1)基态
 原子的简化电子排布式为
原子的简化电子排布式为 原子价层电子轨道表示式为
原子价层电子轨道表示式为 原子未成对电子数目为
原子未成对电子数目为(2)欲提高
 在5.2~5.4时的“浸出”速率,可采用的方法是
在5.2~5.4时的“浸出”速率,可采用的方法是(3)在
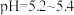 “浸出”时,锌焙砂中的铜转化为
“浸出”时,锌焙砂中的铜转化为 反应的离子方程式为
反应的离子方程式为(4)
 时,浸出液中
时,浸出液中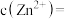
 。
。(5)当有
 、
、 或
或 存在时,调节含
存在时,调节含 溶液的
溶液的 ,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,
,即可生成黄铁矾。不同种类的阳离子“沉铁”效果如图,则工艺流程中,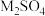 最好选用
最好选用
(6)获得
 的一系列操作是
的一系列操作是
您最近一年使用:0次
2024-02-14更新
|
196次组卷
|
2卷引用:湖北省恩施州高中教育联盟2023-2024学年高二上学期期末考试化学试题
名校
解题方法
5 . 某湿法炼锌的萃余液中含有Na+、Zn2+、Fe2+、Mn2+、Co2+、Cd2+及30~60g·L-1H2SO4等,逐级回收有价值金属并制取活性氧化锌的工艺流程如图:

已知:
回答下列问题:
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;再加入一定量的Na2S2O8(已知S2O 具有强氧化性,还原产物为SO
具有强氧化性,还原产物为SO 。);再加入石灰石调节溶液的pH为4.0(保持溶液的温度为25℃)。
。);再加入石灰石调节溶液的pH为4.0(保持溶液的温度为25℃)。
①“氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为___________ 。
②“沉渣”的主要成分除MnO2外还有___________ 。
③在“中和氧化水解”步骤中进行“氧化”时,若加入过量的Na2S2O8,钴元素将会进入“沉渣”中,则过滤掉“沉渣”后所得的溶液中含钴微粒的浓度为___________ mol·L-1。
(2)“除镉”时,主要反应的离子方程式为___________ 。
(3)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。产生大量气体的原因是___________ 。

已知:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Co(OH)3 | Cd(OH)2 |
| Ksp | 2.6×10-39 | 4.9×10-17 | 5.9×10-15 | 1.6×10-44 | 7.2×10-15 |
(1)“中和氧化水解”时,先加入适量的石灰石调节溶液的pH为1.0;再加入一定量的Na2S2O8(已知S2O
 具有强氧化性,还原产物为SO
具有强氧化性,还原产物为SO 。);再加入石灰石调节溶液的pH为4.0(保持溶液的温度为25℃)。
。);再加入石灰石调节溶液的pH为4.0(保持溶液的温度为25℃)。①“氧化”时,Mn2+转化为MnO2除去,反应的离子方程式为
②“沉渣”的主要成分除MnO2外还有
③在“中和氧化水解”步骤中进行“氧化”时,若加入过量的Na2S2O8,钴元素将会进入“沉渣”中,则过滤掉“沉渣”后所得的溶液中含钴微粒的浓度为
(2)“除镉”时,主要反应的离子方程式为
(3)“沉锌”时,在近中性条件下加入Na2CO3可得碱式碳酸锌[ZnCO3·2Zn(OH)2·H2O]固体,同时产生大量的气体。产生大量气体的原因是
您最近一年使用:0次
6 . 利用含锌废料(主要成分是氧化锌,含有少量铁、铝、铜、锰等金属氧化物或盐)制备氯化锌的一种工艺流程如下:
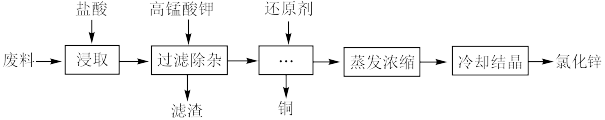
(1)为了提高盐酸浸取效率,可采取的措施有___________ 。
(2)浸取温度不宜超过60℃,原因是___________ 。
(3)为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳 范围为
范围为___________ ,理由是___________ 。
A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0

(4)滤渣的主要成分有 、
、___________ 和 ,该工艺中去除锰的离子方程式为
,该工艺中去除锰的离子方程式为___________ 。
(5)最适宜使用的还原剂是___________ ,理由为___________ 。
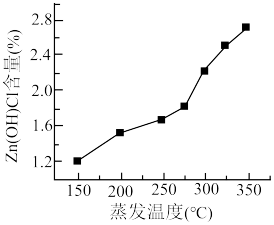
(6)氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐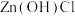 生成,该反应方程式为
生成,该反应方程式为___________ ,产品中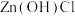 含量与蒸发温度关系如图所示,工艺要求
含量与蒸发温度关系如图所示,工艺要求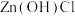 含量不超过2.30%,降低产品中
含量不超过2.30%,降低产品中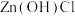 含量的方法有
含量的方法有___________ 。

(1)为了提高盐酸浸取效率,可采取的措施有
(2)浸取温度不宜超过60℃,原因是
(3)为优化工艺流程,盐酸浸取后直接进行高锰酸钾氧化除杂。结合下列图表选择浸取工艺最佳
 范围为
范围为A.1.5~2.0 B.2.0~3.0 C.3.0~4.0 D.4.5~5.0

| 金属离子 | 开始沉淀的  | 沉淀完全的  |
 | 6.8 | 8.3 |
 | 3.7 | 4.7 |
 | 1.8 | 2.8 |
 | 5.2 | 6.7 |
 | 8.6 | 10.1 |
 | 6.7 | 8.2 |
(4)滤渣的主要成分有
 、
、 ,该工艺中去除锰的离子方程式为
,该工艺中去除锰的离子方程式为(5)最适宜使用的还原剂是
(6)氯化锌溶液在蒸发浓缩过程中如操作不当将有碱式盐
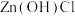 生成,该反应方程式为
生成,该反应方程式为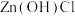 含量与蒸发温度关系如图所示,工艺要求
含量与蒸发温度关系如图所示,工艺要求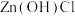 含量不超过2.30%,降低产品中
含量不超过2.30%,降低产品中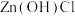 含量的方法有
含量的方法有
您最近一年使用:0次
7 . 碳酸锌常用作轻型收敛剂、配制炉甘石、皮肤保护剂、乳胶制品原料等。以某废锌渣(主要成分为 及一定量的FeS、PbO、ZnS、
及一定量的FeS、PbO、ZnS、 、
、 )为原料制备碳酸锌的工艺流程如图:
)为原料制备碳酸锌的工艺流程如图:

已知:相关金属离子形成氢氧化物沉淀的pH如下表所示。回答下列问题:
(1)为提高“浸出”效率,可采取的措施有___________ (答两条)。
(2)“浸出”时 除直接溶于硫酸外,部分
除直接溶于硫酸外,部分 在酸性条件下与FeS、ZnS发生氧化还原反应。
在酸性条件下与FeS、ZnS发生氧化还原反应。
①滤渣Ⅰ的主要成分除硫单质外,还有___________ (填化学式)。
②“浸出”时,ZnS与 反应的化学方程式为
反应的化学方程式为___________ 。
(3)“转化”步骤中,发生的主要反应的离子方程式为___________ ; 的加入量高于理论值的主要原因为
的加入量高于理论值的主要原因为___________ 。
(4)“净化”时,需调节pH的最佳范围为___________ 。
 及一定量的FeS、PbO、ZnS、
及一定量的FeS、PbO、ZnS、 、
、 )为原料制备碳酸锌的工艺流程如图:
)为原料制备碳酸锌的工艺流程如图:
已知:相关金属离子形成氢氧化物沉淀的pH如下表所示。回答下列问题:
| 金属离子 |  |  |  |  |  |
| 开始沉淀pH | 5.5 | 1.3 | 6.5 | 7.0 | 3.3 |
| 刚好完全沉淀pH | 8.0 | 3.2 | 9.2 | 8.8 | 4.7 |
(1)为提高“浸出”效率,可采取的措施有
(2)“浸出”时
 除直接溶于硫酸外,部分
除直接溶于硫酸外,部分 在酸性条件下与FeS、ZnS发生氧化还原反应。
在酸性条件下与FeS、ZnS发生氧化还原反应。①滤渣Ⅰ的主要成分除硫单质外,还有
②“浸出”时,ZnS与
 反应的化学方程式为
反应的化学方程式为(3)“转化”步骤中,发生的主要反应的离子方程式为
 的加入量高于理论值的主要原因为
的加入量高于理论值的主要原因为(4)“净化”时,需调节pH的最佳范围为
您最近一年使用:0次
解题方法
8 . 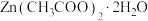 常用作媒染剂、木材防腐剂等。实验室以含锌废液(主要成分为
常用作媒染剂、木材防腐剂等。实验室以含锌废液(主要成分为 ,含少量的
,含少量的 、
、 )为原料制备
)为原料制备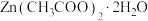 的实验流程如下:
的实验流程如下:

已知:①金属离子开始沉淀和完全沉淀时的pH如表所示。
② 属于两性化合物。
属于两性化合物。
回答下列问题:
(1)已知 中存在一个过氧键(-O-O-),则
中存在一个过氧键(-O-O-),则 中S元素的化合价为
中S元素的化合价为___________ 。
(2)写出“除锰”时生成 的离子方程式:
的离子方程式:___________ 。
(3)“除铁”时调节溶液的pH范围为___________ ,该过程不用Zn代替ZnO调节pH,原因是___________ 。
(4)“沉锌”时溶液的pH不能大于10.5,目的是___________ 。
(5)向 中加入足量醋酸后可得醋酸锌溶液,经
中加入足量醋酸后可得醋酸锌溶液,经___________ 、过滤、洗涤、干燥等一系列操作可得到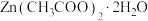 晶体。
晶体。
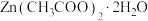 常用作媒染剂、木材防腐剂等。实验室以含锌废液(主要成分为
常用作媒染剂、木材防腐剂等。实验室以含锌废液(主要成分为 ,含少量的
,含少量的 、
、 )为原料制备
)为原料制备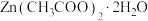 的实验流程如下:
的实验流程如下:
已知:①金属离子开始沉淀和完全沉淀时的pH如表所示。
| 物质 |  |  |  |
| 开始沉淀的pH | 1.9 | 6.8 | 6.2 |
| 完全沉淀的pH | 3.3 | 8.3 | 8.2 |
 属于两性化合物。
属于两性化合物。回答下列问题:
(1)已知
 中存在一个过氧键(-O-O-),则
中存在一个过氧键(-O-O-),则 中S元素的化合价为
中S元素的化合价为(2)写出“除锰”时生成
 的离子方程式:
的离子方程式:(3)“除铁”时调节溶液的pH范围为
(4)“沉锌”时溶液的pH不能大于10.5,目的是
(5)向
 中加入足量醋酸后可得醋酸锌溶液,经
中加入足量醋酸后可得醋酸锌溶液,经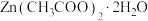 晶体。
晶体。
您最近一年使用:0次
9 . 下列实验的现象与结论相对应的是
| A | B | C | D | |
| 实验 |  |  |  |  |
| 现象 | 电流计指针向右偏(电子由Fe转移到Cu),片刻后向左偏 | 加热一段时间后溶液蓝色褪去 | 加热,肥皂液中产生无色气泡 | 4mol/LH2SO4溶液生成的H2体积多 |
| 结论 | 铁片作负极,论片刻后铜片作负极 | 淀粉在酸性条件下水解,产物是葡萄糖 | 铁粉与水蒸气反应生成H2 | 反应物浓度越大,反应速率越快 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
10 . 氧化锌是一种有独特物理化学性能的功能材料,利用锌焙砂(主要成分为ZnO,含As2O3及铅、铜、镉的氧化物)生产高纯氧化锌的工业流程如图所示。

已知:As2O3 微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)操作X为________ ,需用到的玻璃仪 器有_______ 漏斗、烧杯。
(2)“浸出”过程(NH4)2SO4和NH3·H2O按1:2比例参加反应生成了[Zn(NH3)4]2+,发生的离子反应方程式为_________ 。
(3)流程中可循环利用的含氮物质有______ (填物质化学式)。
(4)已知三种硫化物的Ksp如下表。当溶液中某离子物质的量浓度≤10-5mol/L时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol/L时,此时Pb2+是否完全沉淀_____ (填“是” 或“否”)。
(5)已知“蒸氨”后锌元素以Zn(NH3)2SO4存在, 写出CO2“沉锌”的化学方程式______________ 。
(6)“除砷”过程中,先加入过量的(NH4)2S2O8,然后再加入FeSO4·H2O,该过程中(NH4)2S2O8过量的原因是_____________ 。

已知:As2O3 微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)操作X为
(2)“浸出”过程(NH4)2SO4和NH3·H2O按1:2比例参加反应生成了[Zn(NH3)4]2+,发生的离子反应方程式为
(3)流程中可循环利用的含氮物质有
(4)已知三种硫化物的Ksp如下表。当溶液中某离子物质的量浓度≤10-5mol/L时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol/L时,此时Pb2+是否完全沉淀
| 物质 | CdS | CuS | PbS |
| Ksp | 8.0×10-27 | 6.3×10-36 | 8.0×10-28 |
(5)已知“蒸氨”后锌元素以Zn(NH3)2SO4存在, 写出CO2“沉锌”的化学方程式
(6)“除砷”过程中,先加入过量的(NH4)2S2O8,然后再加入FeSO4·H2O,该过程中(NH4)2S2O8过量的原因是
您最近一年使用:0次



