解题方法
1 . ZnO在医药、石化等领域有广泛的用途。研究小组用某闪锌矿(主要成分ZnS,含有FeS、SiO2、MnCO3等杂质)制备氧化锌和硫单质,设计如下流程:
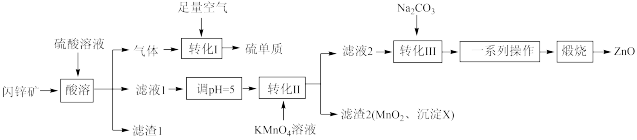
请回答下列问题:
(1)滤渣1的化学式为____________________ ,任写一种该物质的用:______________________ 。
(2)沉淀X的化学式为_______________________________ 。
(3)“转化I”中氧化剂和还原剂的物质的量之比为________________________ 。
(4)“转化II”中主要反应的离子方程式为_____________________________________ 。
(5)若Ksp(ZnCO3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol/L时,认为该离子沉淀完全。则欲使1 L c(Zn2+)=1.5 mol/L溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为____________________ (列出计算式,溶液混合时体积变化忽略不计)。
(6)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有___________________________ ;洗涤沉淀的操作为______________________________________________ 。

请回答下列问题:
(1)滤渣1的化学式为
(2)沉淀X的化学式为
(3)“转化I”中氧化剂和还原剂的物质的量之比为
(4)“转化II”中主要反应的离子方程式为
(5)若Ksp(ZnCO3)=1.5×10-10,溶液中离子浓度≤1.0×10-5 mol/L时,认为该离子沉淀完全。则欲使1 L c(Zn2+)=1.5 mol/L溶液中Zn2+沉淀完全,需加入等体积的Na2CO3溶液的物质的量浓度至少为
(6)“一系列操作”包括过滤、洗涤、干燥。过滤所用的玻璃仪器有
您最近一年使用:0次
2 . 硫酸锌用于制造立德粉,并用作媒染剂、木材防腐剂等.现欲用氧化锌矿(主要成分为ZnO,另含ZnSiO3、FeCO3、CuO等)为原料生产ZnSO4·7H2O,工艺流程如图l:

(l)步骤I的操作是_________ ,滤渣A的主要成分是____________________ 。
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是_________________ 。
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为___________________________________________________ 。
(4)步骤Ⅲ得到的滤液中,阳离子是___________ 。(不考虑H+)
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是_______________________ 。
(6)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。680℃时所得固体的化学式为_______ (填字母序号)。

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O

(l)步骤I的操作是
(2)步骤I加入稀硫酸进行酸浸时,需不断通入高温水蒸气,其目的是
(3)步骤Ⅱ中,在pH约为5.1的滤液中加入高锰酸钾溶液,生成Fe(OH)3和MnO(OH)2两种沉淀,该反应的离子方程式为
(4)步骤Ⅲ得到的滤液中,阳离子是
(5)步骤IV中的烘干操作需在减压低温条件下进行,其原因是
(6)取28.70 g ZnSO4·7H2O加热至不同温度,剩余固体的质量变化如图2所示。680℃时所得固体的化学式为

a.ZnO b.Zn3O(SO4)2 c.ZnSO4 d.ZnSO4·H2O
您最近一年使用:0次
3 . 2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:

请回答下列问题:
(1) (NH4)2SO4与NH3·H2O组成的混合溶液工业上称为缓冲溶液,向该溶液中加入少量强酸或强碱,溶液的PH都不会有明显变化,请分别用离子方程式说明原因_________________________________ 。
(2)“浸取”时为了加快锌的浸出速率,可采取的措施有__________________________ (任写两种);
(3)“浸取”时加入的NH3 • H2O过量,写出生成MnO2的离子方程式_______________________ ;
(4)适量S2-能将Cu2+转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?_______________ ;
用计算说明原因:______________________________ ;
[已知:Ksp(ZnS)=1.6×l0-24 ,Ksp(CuS)=1.3×l0-36
(5)“沉锌”的离子方程式是________________________________________ ;
(6)该过程中,蒸氨所得氨气可循环利用,“过滤III”所得滤液也可循环使用,其主要成分的化学式是___________________________ 。

请回答下列问题:
(1) (NH4)2SO4与NH3·H2O组成的混合溶液工业上称为缓冲溶液,向该溶液中加入少量强酸或强碱,溶液的PH都不会有明显变化,请分别用离子方程式说明原因
(2)“浸取”时为了加快锌的浸出速率,可采取的措施有
(3)“浸取”时加入的NH3 • H2O过量,写出生成MnO2的离子方程式
(4)适量S2-能将Cu2+转化为硫化物沉淀而除去,若选择ZnS进行除杂,是否可行?
用计算说明原因:
[已知:Ksp(ZnS)=1.6×l0-24 ,Ksp(CuS)=1.3×l0-36
(5)“沉锌”的离子方程式是
(6)该过程中,蒸氨所得氨气可循环利用,“过滤III”所得滤液也可循环使用,其主要成分的化学式是
您最近一年使用:0次
解题方法
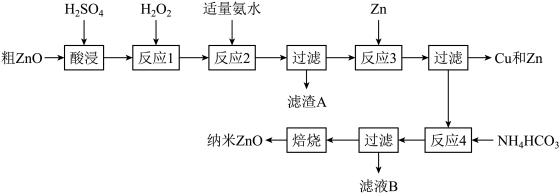
4 . 纳米ZnO的颗粒直径介于1~100nm之间,具有许多特殊的性能,可用于制造变阻器、图像记录材料、磁性材料和塑料薄膜等。一种利用粗ZnO(含FeO、Fe2O3、CuO)制备纳米ZnO的生产工艺流程如下图所示:
已知:① 生成氢氧化物沉淀时溶液的pH如下表:
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有________ (填写两种);
(2)反应1中发生反应的离子方程式为______________ ,一种双氧水的质量分数为34.0 % (密度为1.13g/cm3) ,其浓度为_______ mol/L;
(3)反应2中加适量氨水的目的是_________ ,此时所需pH的范围为_________ ,当调节溶液pH=5时,溶液中的c(Fe3+)=__________ ;
(4)反应3的离子方程式为__________ ,反应类型为__________ ;
(5)从滤液B中可回收的主要物质是__________ ;
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=_________ 。
已知:① 生成氢氧化物沉淀时溶液的pH如下表:
| 物质 | Fe(OH)2 | Fe(OH)3 | Zn(OH)2 | Cu(OH)2 |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
② 25℃时,Fe(OH)3的溶度积常数Ksp=4.0×10-38。
请回答以以下问题:
(1)酸浸时,为了提高浸出率,可采取的措施有
(2)反应1中发生反应的离子方程式为
(3)反应2中加适量氨水的目的是
(4)反应3的离子方程式为
(5)从滤液B中可回收的主要物质是
(6)经检验分析,反应4 所得固体组成为Zna(OH)bCO3,称取该固体22.4g,焙烧后得固体16.2g,则a=
您最近一年使用:0次
解题方法
5 . 锌是一种常用金属,镓(Ga)的化合物氮化镓(GaN)是制造LED的重要材料,被誉为第三代半导体材料。
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为___________________ 。
(2)GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式__________________________ 。
(3)下列有关镓和镓的化合物的说法正确的是____ 。
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:
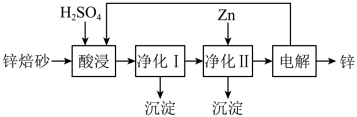
已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为___________________ 。
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________ 。
(6)净化II中加入Zn的目的是___________________ 。
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为_____________ 。已知:Ksp[Fe(OH)3] =8.0× 10-38;lg5 = 0.7
I.镓(Ga)是火法冶炼锌过程中的副产品,镓与铝同主族且相邻,化学性质与铝相似。
(1)Ga的原子结构示意图为
(2)GaN可由Ga和NH3在高温条件下制取,该反应的化学方程式
(3)下列有关镓和镓的化合物的说法正确的是____ 。
| A.常温下,Ga可与水剧烈反应放出氢气 |
| B.一定条件下,Ga可溶于盐酸和氢氧化钠 |
| C.一定条件下,Ga2O3可与NaOH反应生成盐 |
| D.Ga2O3可由Ga(OH)3受热分解得到 |
II.锌的冶炼方法有火法和湿法。工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)湿法制取金属锌的流程如图所示:

已知:Fe的活泼性强于Ni
(4)ZnFe2O4可以写成ZnO·Fe2O3,ZnFe2O4与H2SO4反应的化学方程式为
(5)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,只使Fe3+转化为Fe(OH)3沉淀。净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是
(6)净化II中加入Zn的目的是
(7)常温下,净化I中,如果要使c(Fe3+) < 10-5 mol/L,则应控制溶液pH的范围为
您最近一年使用:0次



