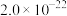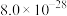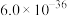1 . 利用废旧镀锌铁皮制备磁性纳米级 及ZnO,制备流程图如下:
及ZnO,制备流程图如下:

已知反应:① ②
②
回答下列问题:
(1)步骤Ⅰ中的分离操作名称是___________ ,溶液A中的溶质有___________ (填化学式)。
(2)步骤Ⅲ中反应的离子方程式是___________ 。
(3)步骤Ⅳ中反应的离子方程式是___________ 。
(4)步骤Ⅵ的主要操作是___________ 。
(5)若废旧镀锌铁皮的质量为10t,步骤Ⅵ所得ZnO质量为4.05t,则原料中铁的质量分数为___________ 。
 及ZnO,制备流程图如下:
及ZnO,制备流程图如下:
已知反应:①
 ②
②
回答下列问题:
(1)步骤Ⅰ中的分离操作名称是
(2)步骤Ⅲ中反应的离子方程式是
(3)步骤Ⅳ中反应的离子方程式是
(4)步骤Ⅵ的主要操作是
(5)若废旧镀锌铁皮的质量为10t,步骤Ⅵ所得ZnO质量为4.05t,则原料中铁的质量分数为
您最近一年使用:0次
名校
2 . 硫酸锌在农业、医药、食品行业中有着广泛的应用。以红锌矿(主要成分为ZnO,还含有少量的FeO、MnO、 等)为原料制备
等)为原料制备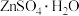 的流程如图:
的流程如图:

回答下列问题:
(1)ZnO中Zn元素的化合价为___________ 。
(2)“酸浸”前要先粉碎,其目的是___________ 。
(3)“浸出渣”的主要成分是___________ 。
(4)“调节pH=5”最适宜的试剂X是___________。
(5)“滤渣”的主要成分为 和
和 ,写出“氧化”时的
,写出“氧化”时的 被氧化的离子方程式
被氧化的离子方程式___________ 。
(6)氧化后检验 是否除尽的方法是
是否除尽的方法是___________ 。
(7)硫酸锌晶体的溶解度随温度的变化如图所示,“操作Ⅰ”是:___________ ,洗涤、干燥。

 等)为原料制备
等)为原料制备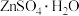 的流程如图:
的流程如图:
回答下列问题:
(1)ZnO中Zn元素的化合价为
(2)“酸浸”前要先粉碎,其目的是
(3)“浸出渣”的主要成分是
(4)“调节pH=5”最适宜的试剂X是___________。
| A.NaOH | B. | C.ZnO | D.CuO |
 和
和 ,写出“氧化”时的
,写出“氧化”时的 被氧化的离子方程式
被氧化的离子方程式(6)氧化后检验
 是否除尽的方法是
是否除尽的方法是(7)硫酸锌晶体的溶解度随温度的变化如图所示,“操作Ⅰ”是:

您最近一年使用:0次
2023-06-01更新
|
119次组卷
|
2卷引用:湖北省新高考协作体2022-2023学年高一下学期5月联考化学试题
3 .  和
和 是非常重要的化工原料,可利用锌精矿(主要成分为ZnS)和软锰矿(主要成分为
是非常重要的化工原料,可利用锌精矿(主要成分为ZnS)和软锰矿(主要成分为 )联合制备,其杂质的组成基本相似,包括
)联合制备,其杂质的组成基本相似,包括 、PbO和Fe、Cu的氧化物等。工艺流程如下:
、PbO和Fe、Cu的氧化物等。工艺流程如下:
已知:
I.常温下,一些难溶电解质的溶度积常数如下表:
II.反萃取:是萃取的逆过程,即被萃取物从有机相返回水相的过程。
回答下列问题:
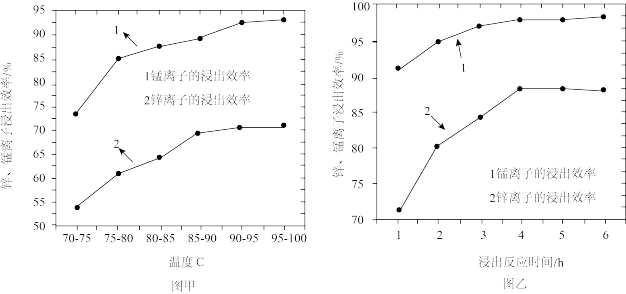
(1)浸取过程中温度和时间对锌和锰浸出率的影响如图甲和图乙所示。从浸出率和节约原料的角度考虑,适宜的浸出温度和时间分别为______________ 、______________ 。
(2)已知滤渣①中含有硫单质,锌精矿和软锰矿在硫酸中浸取生成 和
和 的化学方程式为
的化学方程式为_________ 。
(3)加入 的目的是
的目的是______________ (用离子方程式表示)。
(4)将浸取液的pH调节为5左右,使 形成沉淀而除去,可选用的试剂为 (填字母)
形成沉淀而除去,可选用的试剂为 (填字母)
(5)滤渣③的主要成分是______________ 。
(6)若除铁液中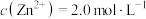 ,加入BaS溶液后,恰好沉淀完成,此时是否有ZnS沉淀生成?
,加入BaS溶液后,恰好沉淀完成,此时是否有ZnS沉淀生成?_____________ (列式计算)。已知当溶液中离子浓度小于 ,认为沉淀完全。
,认为沉淀完全。
(7)从 水相经过
水相经过________ ,过滤,洗涤,干燥等实验操作可以得到 。
。
 和
和 是非常重要的化工原料,可利用锌精矿(主要成分为ZnS)和软锰矿(主要成分为
是非常重要的化工原料,可利用锌精矿(主要成分为ZnS)和软锰矿(主要成分为 )联合制备,其杂质的组成基本相似,包括
)联合制备,其杂质的组成基本相似,包括 、PbO和Fe、Cu的氧化物等。工艺流程如下:
、PbO和Fe、Cu的氧化物等。工艺流程如下:
已知:
I.常温下,一些难溶电解质的溶度积常数如下表:
难溶电解质 | ZnS | MnS | PbS | CuS |
|
|
|
|
|
回答下列问题:
(1)浸取过程中温度和时间对锌和锰浸出率的影响如图甲和图乙所示。从浸出率和节约原料的角度考虑,适宜的浸出温度和时间分别为

(2)已知滤渣①中含有硫单质,锌精矿和软锰矿在硫酸中浸取生成
 和
和 的化学方程式为
的化学方程式为(3)加入
 的目的是
的目的是(4)将浸取液的pH调节为5左右,使
 形成沉淀而除去,可选用的试剂为 (填字母)
形成沉淀而除去,可选用的试剂为 (填字母)A. | B.ZnO | C.NaOH | D.MnO |
(6)若除铁液中
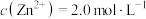 ,加入BaS溶液后,恰好沉淀完成,此时是否有ZnS沉淀生成?
,加入BaS溶液后,恰好沉淀完成,此时是否有ZnS沉淀生成? ,认为沉淀完全。
,认为沉淀完全。(7)从
 水相经过
水相经过 。
。
您最近一年使用:0次
2023-05-21更新
|
91次组卷
|
3卷引用:广东省清中、河中、北中、惠中、阳中五校2022-2023学年高二下学期联考化学试题
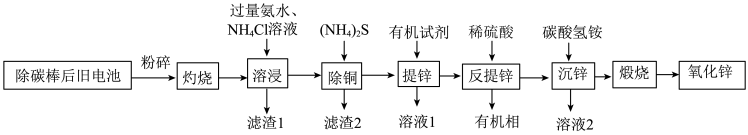
4 . 随着生活水平的提高,旧电池的回收利用成为当前世界各国研究的重要课题,我国科学家提出利用旧干电池(除碳棒后,主要成分为:Zn、Fe、Cu、 、
、 以及
以及 )回收氧化锌的流程如图:
)回收氧化锌的流程如图:
已知:
①二氧化锰难溶于水、弱酸、弱碱。锌、铜氧化物及其盐能溶于氨水形成配合物(如 )。
)。
②室温下, ,
, 。
。
③室温下,一些金属氢氧化物沉淀时的pH如下表:
回答下列问题:
(1)旧电池灼烧的目的是__________ ;滤渣1的主要成分是__________ (填化学式)。
(2)若在实验室中进行“提锌”操作,该操作的名称为__________ 。
(3) 含有的
含有的 键数为
键数为__________  ;氧化铜的熔点比硫化铜高的原因是
;氧化铜的熔点比硫化铜高的原因是__________ 。
(4)室温下,测得除铜后溶液中: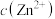 为
为 、
、 为
为 ,此时溶液中
,此时溶液中
__________ (填“能”或“不能”)形成沉淀。
(5)工业上常采用电解硫酸锌溶液的方法制备锌,阴极电极反应式为__________ 。
 、
、 以及
以及 )回收氧化锌的流程如图:
)回收氧化锌的流程如图:
已知:
①二氧化锰难溶于水、弱酸、弱碱。锌、铜氧化物及其盐能溶于氨水形成配合物(如
 )。
)。②室温下,
 ,
, 。
。③室温下,一些金属氢氧化物沉淀时的pH如下表:
金属氢氧化物 |
|
|
|
开始沉淀的pH | 2.3 | 5.9 | 5.4 |
完全沉淀的pH | 3.2 | 8.2(>10时溶解) | 6.7 |
(1)旧电池灼烧的目的是
(2)若在实验室中进行“提锌”操作,该操作的名称为
(3)
 含有的
含有的 键数为
键数为 ;氧化铜的熔点比硫化铜高的原因是
;氧化铜的熔点比硫化铜高的原因是(4)室温下,测得除铜后溶液中:
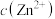 为
为 、
、 为
为 ,此时溶液中
,此时溶液中
(5)工业上常采用电解硫酸锌溶液的方法制备锌,阴极电极反应式为
您最近一年使用:0次
名校
5 . 下列“类比”或“对比”合理的是
| A.Mg在CO2中点燃反应生成MgO和C,则Zn在CO2中点燃反应生成ZnO和C |
| B.Na3N与盐酸反应生成NaCl和NH4Cl,则Mg3N2与盐酸反应生成MgCl2和NH4Cl |
| C.NaClO溶液与少量CO2反应生成NaHCO3和HClO,则Ca(ClO)2溶液与少量CO2反应生成Ca(HCO3)2和HClO |
| D.NaOH溶液与少量AgNO3溶液反应生成Ag2O和NaNO3,则氨水与少量AgNO3溶液反应最终生成Ag2O和NH4NO3 |
您最近一年使用:0次
2023-05-10更新
|
272次组卷
|
2卷引用:江西省宜春市上高二中2022-2023学年高二下学期第二次月考(期中) 化学试题
名校
解题方法
6 . 高纯ZnO可用作电子元件材料。以次氧化锌酸浸液(主要含有 、
、 ,还含有
,还含有 、
、 、
、 、
、 等)为原料制备高纯ZnO的实验流程如下:
等)为原料制备高纯ZnO的实验流程如下:
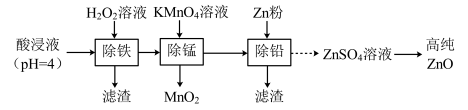
已知:常温下,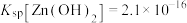 ,
,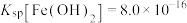 ,
,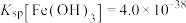 。
。
(1)“除铁”时,须将 氧化为
氧化为 的原因是
的原因是___________ 。
(2)“除锰”反应的离子方程式为___________ 。其他条件不变时,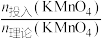 与锰去除率、溶液中锰含量的关系如图所示。
与锰去除率、溶液中锰含量的关系如图所示。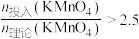 时,溶液中锰去除率下降,其原因是
时,溶液中锰去除率下降,其原因是___________ 。
(3)为考查Zn粉用量对“除铅”过程中铅元素去除率的影响,设计若干对照实验组,这些实验组控制不变的因素有:“除锰”滤液浓度与体积、反应温度、___________ 。
(4)写出以“ 溶液”为原料制备高纯ZnO的实验方案:
溶液”为原料制备高纯ZnO的实验方案:___________ 。[可选用的试剂: 溶液、氨水-
溶液、氨水- 混合溶液、蒸馏水、稀盐酸、
混合溶液、蒸馏水、稀盐酸、 溶液]
溶液]
 、
、 ,还含有
,还含有 、
、 、
、 、
、 等)为原料制备高纯ZnO的实验流程如下:
等)为原料制备高纯ZnO的实验流程如下:
已知:常温下,
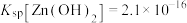 ,
,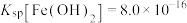 ,
,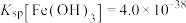 。
。(1)“除铁”时,须将
 氧化为
氧化为 的原因是
的原因是(2)“除锰”反应的离子方程式为
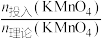 与锰去除率、溶液中锰含量的关系如图所示。
与锰去除率、溶液中锰含量的关系如图所示。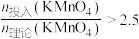 时,溶液中锰去除率下降,其原因是
时,溶液中锰去除率下降,其原因是
(3)为考查Zn粉用量对“除铅”过程中铅元素去除率的影响,设计若干对照实验组,这些实验组控制不变的因素有:“除锰”滤液浓度与体积、反应温度、
(4)写出以“
 溶液”为原料制备高纯ZnO的实验方案:
溶液”为原料制备高纯ZnO的实验方案: 溶液、氨水-
溶液、氨水- 混合溶液、蒸馏水、稀盐酸、
混合溶液、蒸馏水、稀盐酸、 溶液]
溶液]
您最近一年使用:0次
2023-05-08更新
|
764次组卷
|
2卷引用:江苏省南京市2023届高三5月第二次模拟考试化学试题
解题方法
7 . ZnO是重要的化工原料。实验室以粗氧化锌(主要成分为ZnO,还含有少量Fe2O3、CuO等杂质)为原料制备碱式碳酸锌,进而热分解制备活性氧化锌。实验流程如下:

(1)“浸出”:称取一定量的粗氧化锌放入反应器中,加入适量碳酸氢铵和15%的氨水,40℃水浴加热并充分搅拌后,过滤。
①浸出后溶液中主要含有的离子为 、
、 和
和 ,写出生成[Zn(NH3)4]CO3的化学方程式:
,写出生成[Zn(NH3)4]CO3的化学方程式:__________ 。1 mol[Zn(NH3)4]2+中的σ键数为__________ 。
②其他条件一定,当水浴温度高于42℃时,测得锌的浸出率随温度升高而降低,其可能原因是________ 。
(2)“置换铜”:向“浸出”所得滤液中加入稍过量的锌粉,过滤,___________ ,过滤、洗涤并烘干滤渣,得到较纯净的铜。
(3)“蒸氨”。反应原理为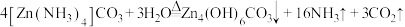 。已知:
。已知: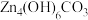 的产率随蒸氨时间的变化如图-1所示:加热Zn4(OH)6CO330 min后,固体质量残留率
的产率随蒸氨时间的变化如图-1所示:加热Zn4(OH)6CO330 min后,固体质量残留率 随温度变化如图-2所示。
随温度变化如图-2所示。
请补充完整制备ZnO的实验方案:将[Zn(NH3)4]CO3溶液置于如图-3所示三颈瓶中,____________ 。(实验中须使用的试剂:100℃水蒸气、蒸馏水)


(1)“浸出”:称取一定量的粗氧化锌放入反应器中,加入适量碳酸氢铵和15%的氨水,40℃水浴加热并充分搅拌后,过滤。
①浸出后溶液中主要含有的离子为
 、
、 和
和 ,写出生成[Zn(NH3)4]CO3的化学方程式:
,写出生成[Zn(NH3)4]CO3的化学方程式:②其他条件一定,当水浴温度高于42℃时,测得锌的浸出率随温度升高而降低,其可能原因是
(2)“置换铜”:向“浸出”所得滤液中加入稍过量的锌粉,过滤,
(3)“蒸氨”。反应原理为
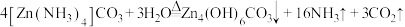 。已知:
。已知: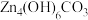 的产率随蒸氨时间的变化如图-1所示:加热Zn4(OH)6CO330 min后,固体质量残留率
的产率随蒸氨时间的变化如图-1所示:加热Zn4(OH)6CO330 min后,固体质量残留率 随温度变化如图-2所示。
随温度变化如图-2所示。请补充完整制备ZnO的实验方案:将[Zn(NH3)4]CO3溶液置于如图-3所示三颈瓶中,

您最近一年使用:0次
8 . 在明代宋应星所著的《天工开物》中,有关于火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成团。冷定毁罐取出……即倭铅也。”据此火法炼锌反应的化学方程式为:ZnCO3+2C Zn+3CO↑。下列有关说法正确的是
Zn+3CO↑。下列有关说法正确的是
 Zn+3CO↑。下列有关说法正确的是
Zn+3CO↑。下列有关说法正确的是| A.在该反应中只有Zn被还原 | B.在该反应中ZnCO3是还原剂 |
| C.CO既是氧化产物又是还原产物 | D.每生成3molCO,转移4mol电子 |
您最近一年使用:0次
2023-04-06更新
|
186次组卷
|
3卷引用:云南省玉溪第一中学2022-2023学年高一上学期第一月考化学试题
9 . 硫酸锌 是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为
是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为 ,杂质为
,杂质为 以及
以及 、
、 、
、 、
、 等的化合物。硫酸锌晶体制备流程如图:
等的化合物。硫酸锌晶体制备流程如图:

已知:常温下,金属离子开始沉淀和完全沉淀时的 如下表所示:
如下表所示:
回答下列问题;
(1)“焙烧”前,常将菱锌矿粉碎,其目的是_______ 。
(2)“滤渣①”的成分是_______ 、 。
。
(3)“氧化”时加入双氧水,写出该工序中发生反应的离子方程式:_______ 。
(4)若“滤渣②”的成分为 、
、 、
、 ,则用
,则用 调溶液
调溶液
_______ ,利用所给数据计算 的
的
_______ 。
(5)从滤液④获得硫酸锌晶体的具体操作为_______ 、过滤、洗涤、干燥。
 是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为
是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备,菱锌矿的主要成分为 ,杂质为
,杂质为 以及
以及 、
、 、
、 、
、 等的化合物。硫酸锌晶体制备流程如图:
等的化合物。硫酸锌晶体制备流程如图:
已知:常温下,金属离子开始沉淀和完全沉淀时的
 如下表所示:
如下表所示:| 金属离子 |  |  |  |  |  |
开始沉淀时 | 1.9 | 6.4 | 4.7 | 7.0 | 9.1 |
沉淀完全时 | 3.4 | 8.4 | 6.7 | 9.0 | 11.1 |
(1)“焙烧”前,常将菱锌矿粉碎,其目的是
(2)“滤渣①”的成分是
 。
。(3)“氧化”时加入双氧水,写出该工序中发生反应的离子方程式:
(4)若“滤渣②”的成分为
 、
、 、
、 ,则用
,则用 调溶液
调溶液
 的
的
(5)从滤液④获得硫酸锌晶体的具体操作为
您最近一年使用:0次
2023-04-01更新
|
153次组卷
|
2卷引用:云南省保山市高(完)中C、D类学校2022~2023学年高二下学期3月份联考化学试题
解题方法
10 . 四水合磷酸锌[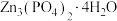 ,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、
,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、 、
、 等)为原料制备
等)为原料制备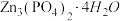 的流程如下:
的流程如下:
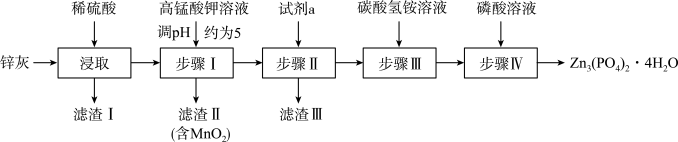
已知: ,
, 。
。
下列说法错误的是
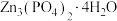 ,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、
,难溶于水]是一种性能优良的绿色环保防锈颜料。实验室以锌灰(含Zn、ZnO、PbO、CuO、FeO、 、
、 等)为原料制备
等)为原料制备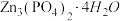 的流程如下:
的流程如下:
已知:
 ,
, 。
。下列说法错误的是
A.滤渣工的主要成分是 |
B.步骤I中,调节溶液的pH约为5后加 溶液反应的离子方程式为 溶液反应的离子方程式为 |
C.若试剂a为ZnS,反应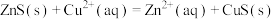 的 的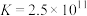 |
| D.为提高锌元素的利用率,可将分离出四水合磷酸锌的母液收集、循环使用 |
您最近一年使用:0次