名校
解题方法
1 . 氧化锌是一种有独特物理化学性能的功能材料,利用锌焙砂(主要成分为ZnO,含As2O3及铅、铜、镉的氧化物)生产高纯氧化锌的工业流程如图所示。

已知:As2O3 微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)操作X为________ ,需用到的玻璃仪 器有_______ 漏斗、烧杯。
(2)“浸出”过程(NH4)2SO4和NH3·H2O按1:2比例参加反应生成了[Zn(NH3)4]2+,发生的离子反应方程式为_________ 。
(3)流程中可循环利用的含氮物质有______ (填物质化学式)。
(4)已知三种硫化物的Ksp如下表。当溶液中某离子物质的量浓度≤10-5mol/L时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol/L时,此时Pb2+是否完全沉淀_____ (填“是” 或“否”)。
(5)已知“蒸氨”后锌元素以Zn(NH3)2SO4存在, 写出CO2“沉锌”的化学方程式______________ 。
(6)“除砷”过程中,先加入过量的(NH4)2S2O8,然后再加入FeSO4·H2O,该过程中(NH4)2S2O8过量的原因是_____________ 。

已知:As2O3 微溶于水而生成亚砷酸(H3AsO3),FeAsO4和ZnCO3难溶于水。
回答下列问题:
(1)操作X为
(2)“浸出”过程(NH4)2SO4和NH3·H2O按1:2比例参加反应生成了[Zn(NH3)4]2+,发生的离子反应方程式为
(3)流程中可循环利用的含氮物质有
(4)已知三种硫化物的Ksp如下表。当溶液中某离子物质的量浓度≤10-5mol/L时视为沉淀完全,则在加Na2S使Cu2+在溶液中的残留浓度为10-10mol/L时,此时Pb2+是否完全沉淀
| 物质 | CdS | CuS | PbS |
| Ksp | 8.0×10-27 | 6.3×10-36 | 8.0×10-28 |
(5)已知“蒸氨”后锌元素以Zn(NH3)2SO4存在, 写出CO2“沉锌”的化学方程式
(6)“除砷”过程中,先加入过量的(NH4)2S2O8,然后再加入FeSO4·H2O,该过程中(NH4)2S2O8过量的原因是
您最近一年使用:0次
名校
解题方法
2 . 下列反应不能用划线反应物所具有的类别通性解释的是
A.碱: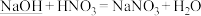 | B.金属单质: |
C.酸: | D.酸性氧化物: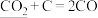 |
您最近一年使用:0次
名校
解题方法
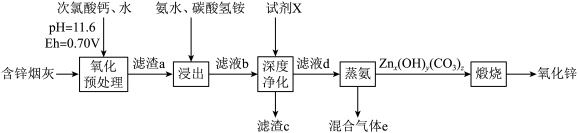
3 . 氧化锌是一种白色粉末,可溶于酸、氢氧化钠溶液、氨水和氨水-铵盐缓冲溶液中,它在橡胶、涂料、医疗及食品等行业有着广泛应用。一种由含锌烟灰(含有ZnO、CuO、PbO、FeO、 、MnO、
、MnO、 、CdO等)制备氧化锌工艺如图:
、CdO等)制备氧化锌工艺如图:
ⅰ)二价金属氧化物如Fe(Ⅱ)、Mn(Ⅱ)与氨络合可生成 、
、 ;
;
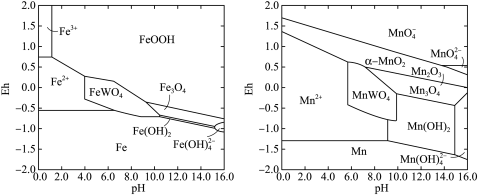
ⅱ)Fe、Mn元素对应优势微粒与溶液的pH及氧化剂氧化电位(Eh)关系如图:
(1) 基态核外电子能级共
基态核外电子能级共_____ 个。
(2)“氧化预处理”时,加入 溶液的目的为将含锌烟灰中的铁(Ⅱ)和锰(Ⅱ)分别氧化,写出氧化铁(Ⅱ)的离子方程式为
溶液的目的为将含锌烟灰中的铁(Ⅱ)和锰(Ⅱ)分别氧化,写出氧化铁(Ⅱ)的离子方程式为_____ 。
(3)“浸出”时生成多种配离子,其中生成 的离子方程式为
的离子方程式为_____ 。
(4)“深度净化”时,可采用加入足量锌粉。该方案所得滤渣c中除了含Zn、Cd之外,还含有(填化学式)_____ 。
(5)“蒸氨”时得混合气体e和固体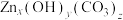 。气体e可返回至
。气体e可返回至_____ 工序循环利用;取11.2固体,经充分“煅烧”后得到氧化锌8.1g,同时产生的气体通入到足量 溶液中,得沉淀9.85g,则固体
溶液中,得沉淀9.85g,则固体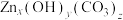 的化学式为
的化学式为_____ 。
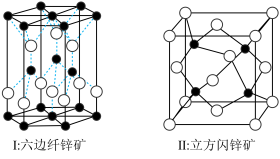
(6)氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图。六边纤锌矿和立方闪锌矿中锌的配位数分别为_____ 、_____ 。
 、MnO、
、MnO、 、CdO等)制备氧化锌工艺如图:
、CdO等)制备氧化锌工艺如图:
ⅰ)二价金属氧化物如Fe(Ⅱ)、Mn(Ⅱ)与氨络合可生成
 、
、 ;
;ⅱ)Fe、Mn元素对应优势微粒与溶液的pH及氧化剂氧化电位(Eh)关系如图:

(1)
 基态核外电子能级共
基态核外电子能级共(2)“氧化预处理”时,加入
 溶液的目的为将含锌烟灰中的铁(Ⅱ)和锰(Ⅱ)分别氧化,写出氧化铁(Ⅱ)的离子方程式为
溶液的目的为将含锌烟灰中的铁(Ⅱ)和锰(Ⅱ)分别氧化,写出氧化铁(Ⅱ)的离子方程式为(3)“浸出”时生成多种配离子,其中生成
 的离子方程式为
的离子方程式为(4)“深度净化”时,可采用加入足量锌粉。该方案所得滤渣c中除了含Zn、Cd之外,还含有(填化学式)
(5)“蒸氨”时得混合气体e和固体
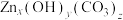 。气体e可返回至
。气体e可返回至 溶液中,得沉淀9.85g,则固体
溶液中,得沉淀9.85g,则固体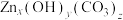 的化学式为
的化学式为(6)氧化锌有六边纤锌矿和立方闪锌矿两种常见晶体结构,晶胞结构如图。六边纤锌矿和立方闪锌矿中锌的配位数分别为

您最近一年使用:0次
2023-11-23更新
|
272次组卷
|
2卷引用:辽宁省沈阳市第一二〇中学2023-2024学年高三上学期第四次质量监测化学试题
解题方法
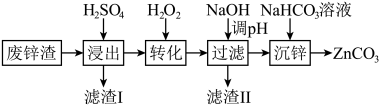
4 . 以某废锌渣(主要成分为 及一定量的
及一定量的 、
、 、
、 、
、 、
、 )为原料制备碳酸锌的工艺流程如图:
)为原料制备碳酸锌的工艺流程如图:
已知:相关金属离子形成氢氧化物沉淀的 如表所示:
如表所示:
回答下列问题:
(1)为提高“浸出”效率,可采取的措施有___________ (任意回答两条)。
(2)铁酸锌( )中铁元素的化合价为
)中铁元素的化合价为___________ 。
(3)“浸出”时 除直接溶于硫酸外,有部分
除直接溶于硫酸外,有部分 在酸性条件下与
在酸性条件下与 发生了氧化还原反应。
发生了氧化还原反应。
①“浸出”步骤中,滤渣I的主要成分除硫单质外还有___________ (填化学式)。
②写出在酸性条件下 与
与 反应的化学方程式:
反应的化学方程式:___________ 。
(4)“转化”步骤中,发生的主要反应的离子方程式为___________ ; 的加入量高于理论值的主要原因为
的加入量高于理论值的主要原因为___________ 。
(5)“调 ”时需调节
”时需调节 的最佳范围为
的最佳范围为___________ 。
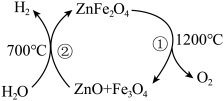
(6)铁酸锌可用于循环分解水制氢气,其反应原理如图所示,反应①中氧化产物与还原产物的物质的量之比为___________ 。
 及一定量的
及一定量的 、
、 、
、 、
、 、
、 )为原料制备碳酸锌的工艺流程如图:
)为原料制备碳酸锌的工艺流程如图:
已知:相关金属离子形成氢氧化物沉淀的
 如表所示:
如表所示:| 金属离子 |  |  |  |  |  |
开始沉淀 | 5.5 | 1.3 | 6.5 | 7.0 | 3.3 |
刚好完全沉淀 | 8.0 | 3.2 | 9.2 | 8.8 | 4.7 |
(1)为提高“浸出”效率,可采取的措施有
(2)铁酸锌(
 )中铁元素的化合价为
)中铁元素的化合价为(3)“浸出”时
 除直接溶于硫酸外,有部分
除直接溶于硫酸外,有部分 在酸性条件下与
在酸性条件下与 发生了氧化还原反应。
发生了氧化还原反应。①“浸出”步骤中,滤渣I的主要成分除硫单质外还有
②写出在酸性条件下
 与
与 反应的化学方程式:
反应的化学方程式:(4)“转化”步骤中,发生的主要反应的离子方程式为
 的加入量高于理论值的主要原因为
的加入量高于理论值的主要原因为(5)“调
 ”时需调节
”时需调节 的最佳范围为
的最佳范围为(6)铁酸锌可用于循环分解水制氢气,其反应原理如图所示,反应①中氧化产物与还原产物的物质的量之比为

您最近一年使用:0次
2023-11-06更新
|
983次组卷
|
2卷引用:河南省名校青桐鸣大联考2024届高三上学期10月联考化学试题
解题方法
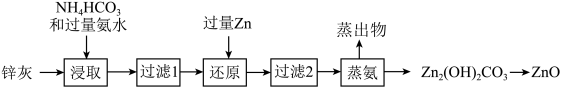
5 . 氧化锌是一种常用的化学添加剂,以钢铁厂锌灰(主要成分为ZnO,含少量的CuO、 、
、 等)为原料制备氧化锌的工艺流程如下:
等)为原料制备氧化锌的工艺流程如下:
下列说法错误的是
 、
、 等)为原料制备氧化锌的工艺流程如下:
等)为原料制备氧化锌的工艺流程如下:
下列说法错误的是
A.浸取过程中ZnO转变为 的离子方程式为 的离子方程式为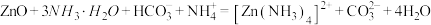 |
B.过滤1所得滤液中大量存在的离子有 、 、 、 、 |
| C.蒸出物用水吸收后可返回至浸取单元循环使用 |
| D.浸取和蒸氨的操作均应在较高温度下进行 |
您最近一年使用:0次
2023-10-11更新
|
228次组卷
|
2卷引用:山东省潍坊市五县区2023-2024学年高三上学期10月阶段监测化学试题
名校
解题方法
6 . 黄铜渣中约含Zn7%、ZnO31%、Cu50%、CuO5%,其余为杂质。处理黄铜渣可得到硫酸锌,其主要流程如下图(杂质不溶于水、不参与反应):
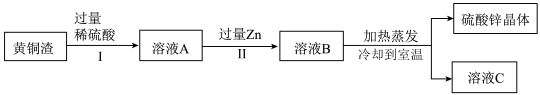
下列说法正确的是

下列说法正确的是
| A.溶液A中的溶质有2种 |
| B.Ⅰ、Ⅱ中的操作均包含过滤 |
| C.溶液A的质量大于溶液B |
| D.溶液C中溶质的质量分数小于溶液B |
您最近一年使用:0次
名校
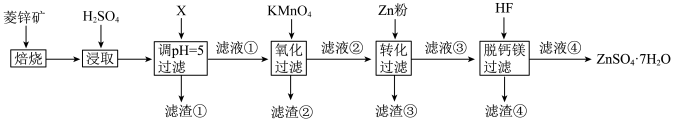
7 . 硫酸锌(ZnSO4)是制备各种含锌材料的原料,在防腐、电镀、医学上有诸多应用。硫酸锌可由菱锌矿制备。菱锌矿的主要成分为ZnCO3,杂质为SiO2以及Ca、Mg、Fe、Cu等的化合物。其制备流程如下:
本题中所涉及离子的氢氧化物溶度积常数如下表:
回答下列问题:
(1)Zn在元素周期表中的位置_______ ,基态S原子电子占据最高能级的电子云轮廓图为_______ 形。
(2)菱锌矿焙烧生成氧化锌的化学方程式为_______ 。
(3)为了提高锌的浸取效果,可采取的措施有_______ 、_______ 。
(4)加入物质X调溶液pH=5,最适宜使用的X是_______ (填标号)。
A.NH3H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是_______ 、_______ 、_______ 。
(5)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为_______ 。
(6)滤液②中加入锌粉的目的是_______ 。
(7)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是_______ 、_______ 。

本题中所涉及离子的氢氧化物溶度积常数如下表:
| 离子 | Fe3+ | Zn2+ | Cu2+ | Fe2+ | Mg2+ |
| Ksp | 4.010-38 | 6.710-17 | 2.210-20 | 8.010-16 | 1.81011 |
(1)Zn在元素周期表中的位置
(2)菱锌矿焙烧生成氧化锌的化学方程式为
(3)为了提高锌的浸取效果,可采取的措施有
(4)加入物质X调溶液pH=5,最适宜使用的X是
A.NH3H2O B.Ca(OH)2 C.NaOH
滤渣①的主要成分是
(5)向80~90℃的滤液①中分批加入适量KMnO4溶液充分反应后过滤,滤渣②中有MnO2,该步反应的离子方程式为
(6)滤液②中加入锌粉的目的是
(7)滤渣④与浓H2SO4反应可以释放HF并循环利用,同时得到的副产物是
您最近一年使用:0次
名校
解题方法
8 . 实验室用氨法浸出氧化锌烟尘制备活性 ,其主要实验流程如下:
,其主要实验流程如下:

(1)浸出。用一定浓度的管水和 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。
① 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为___________ ,位于元素周期表中的___________ 区。
②烟尘中的主要成分 发生反应的化学方程式为
发生反应的化学方程式为___________ 。
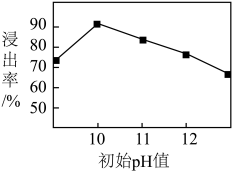
③锌元素的浸出率随浸出液初始 的变化关系如图所示。当浸出液初始
的变化关系如图所示。当浸出液初始 大于10时,浸出率随
大于10时,浸出率随 增大而减小的原因是
增大而减小的原因是___________ 。
(2)除杂。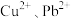 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入 粉可将它们置换除去。写出
粉可将它们置换除去。写出 粉和铜氨配合物反应的离子方程式
粉和铜氨配合物反应的离子方程式___________ 。
(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以 沉淀形式从溶液中析出。该过程需保持恒温
沉淀形式从溶液中析出。该过程需保持恒温 ,可采取的加热方式为
,可采取的加热方式为___________ 。
(4)焙解。已知 和
和 的分解温度分别为
的分解温度分别为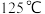 、
、 。实验室加热碱式碳酸锌
。实验室加热碱式碳酸锌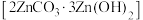 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
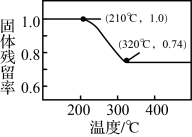
①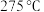 时,碱式碳酸锌分解产生的气态物质为
时,碱式碳酸锌分解产生的气态物质为___________ (填化学式)。
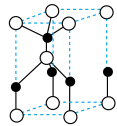
②经焙解得到的活性 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为___________ 。
 ,其主要实验流程如下:
,其主要实验流程如下:
(1)浸出。用一定浓度的管水和
 配成的混合液浸取氧化锌烟尘,得到锌氨
配成的混合液浸取氧化锌烟尘,得到锌氨 浸出液。
浸出液。①
 元素基态原子的外围电子排布式为
元素基态原子的外围电子排布式为②烟尘中的主要成分
 发生反应的化学方程式为
发生反应的化学方程式为③锌元素的浸出率随浸出液初始
 的变化关系如图所示。当浸出液初始
的变化关系如图所示。当浸出液初始 大于10时,浸出率随
大于10时,浸出率随 增大而减小的原因是
增大而减小的原因是
(2)除杂。
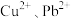 等杂质也与氨水形成配合物存在于浸出后的滤液中,加入
等杂质也与氨水形成配合物存在于浸出后的滤液中,加入 粉可将它们置换除去。写出
粉可将它们置换除去。写出 粉和铜氨配合物反应的离子方程式
粉和铜氨配合物反应的离子方程式(3)蒸氨。加热时溶液中过量的氨和铵被蒸出,锌氨配合物最终以
 沉淀形式从溶液中析出。该过程需保持恒温
沉淀形式从溶液中析出。该过程需保持恒温 ,可采取的加热方式为
,可采取的加热方式为(4)焙解。已知
 和
和 的分解温度分别为
的分解温度分别为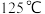 、
、 。实验室加热碱式碳酸锌
。实验室加热碱式碳酸锌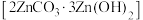 时测得的固体残留率随温度的变化关系如图所示。
时测得的固体残留率随温度的变化关系如图所示。
①
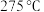 时,碱式碳酸锌分解产生的气态物质为
时,碱式碳酸锌分解产生的气态物质为②经焙解得到的活性
 晶胞结构如图所示。该晶胞中
晶胞结构如图所示。该晶胞中 原子的配位数为
原子的配位数为
您最近一年使用:0次
2023-09-18更新
|
323次组卷
|
2卷引用:江苏省昆山中学2022-2023学年高一下学期5月月考化学试题
名校
解题方法
9 . 往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为mg的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图所示,下列说法中正确的是


| A.c点对应溶液中含有的金属离子为Zn2+和Cu2+ |
| B.bc段(不含两端点)析出的金属是Fe |
| C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+和Cu2+ |
| D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,则m1<m2 |
您最近一年使用:0次
名校
10 . 镁菱锌矿(主要成分为ZnCO3、MgCO3等,含有少量FeCO3、CaCO3等杂质)可用于生产媒染剂、防腐剂ZnSO4•7H2O以及耐火材料MgO。制备工艺流程如图:
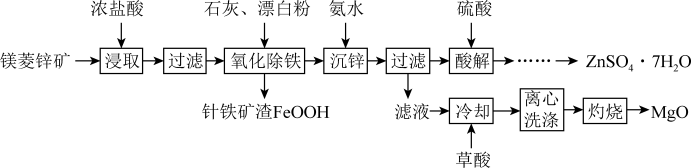
已知:65℃时Ksp[Mg(OH)2]=1.8×10-11;Ksp[Zn(OH)2]=2.0×10-17,Kw=10-13;lg2≈0.3。
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是_______ ,还可采用_______ (写出一种)等方式达到此目的。
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为_______ 。
(3)“沉锌”前,滤液(65℃)中含有0.50mol•L-1 Zn2+和1.8mol•L-1 Mg2+,保持该温度,则应加入氨水调节pH在________ 范围(c≤1.0×10-5mol•L-1,沉淀完全)。利用平衡移动原理说明“沉锌”时加入氨水的作用________ 。
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、_______ 、过滤、洗涤、干燥。制得的ZnSO4•7H2O在烘干时需减压烘干的原因是________ 。
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:________ 。

已知:65℃时Ksp[Mg(OH)2]=1.8×10-11;Ksp[Zn(OH)2]=2.0×10-17,Kw=10-13;lg2≈0.3。
回答下列有关问题:
(1)浓盐酸浸取矿石时,保持较大液固体积比(如3:1),目的是
(2)“氧化除铁”在90℃,控制溶液pH在4.0~5.0,得到针铁矿渣的离子方程式为
(3)“沉锌”前,滤液(65℃)中含有0.50mol•L-1 Zn2+和1.8mol•L-1 Mg2+,保持该温度,则应加入氨水调节pH在
(4)“酸解”后获得ZnSO4•7H2O的操作依次经过蒸发浓缩、
(5)“滤液”中加入H2C2O4饱和溶液产生MgC2O4沉淀,若“灼烧”时产生两种气体,则该反应的化学方程式为:
您最近一年使用:0次



