1 . 某甲醇合成催化剂常因硫中毒而失活,以该废催化剂(主要含Cu、Zn、Al、O、S、N、C等元素)回收铜、锌的工艺流程如图:
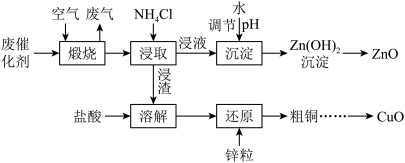
已知: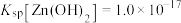
(1)“搬烧”时,烧炉内温度、煅烧时间与烧失率(烧失率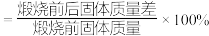 )的关系如下图所示。
)的关系如下图所示。

①温度为950℃时,60min之前烧失率增加的原因是_______ 。
②为了提高烧失率,除适宜的温度和时间外,还可以采取的措施有_______ 。
(2)控制“浸取”温度为75℃,浸取后锌元素主要以 存在,反应达到平衡时存在如下关系:
存在,反应达到平衡时存在如下关系: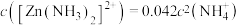 ,
,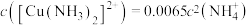 。
。
①浸取ZnO的离子方程式为_______ 。控制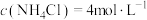 能使大部分ZnO进入浸液,大部分CuO留在浸渣,原因是
能使大部分ZnO进入浸液,大部分CuO留在浸渣,原因是_______ 。
②温度控制在75℃左右,其原因是_______ 。
(3)“沉淀”时,若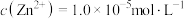 ,滤液的
,滤液的
_______ 。
(4)“还原”反应的离子方程式为_______ 。
(5)流程中可循环使用的物质是_______ (填化学式)。

已知:
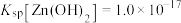
(1)“搬烧”时,烧炉内温度、煅烧时间与烧失率(烧失率
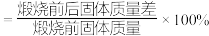 )的关系如下图所示。
)的关系如下图所示。
①温度为950℃时,60min之前烧失率增加的原因是
②为了提高烧失率,除适宜的温度和时间外,还可以采取的措施有
(2)控制“浸取”温度为75℃,浸取后锌元素主要以
 存在,反应达到平衡时存在如下关系:
存在,反应达到平衡时存在如下关系: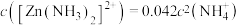 ,
,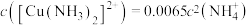 。
。①浸取ZnO的离子方程式为
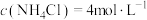 能使大部分ZnO进入浸液,大部分CuO留在浸渣,原因是
能使大部分ZnO进入浸液,大部分CuO留在浸渣,原因是②温度控制在75℃左右,其原因是
(3)“沉淀”时,若
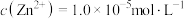 ,滤液的
,滤液的
(4)“还原”反应的离子方程式为
(5)流程中可循环使用的物质是
您最近一年使用:0次
2 . 市政污泥含大量金属(Cu、Zn、Ni、Fe、Ag等),不经处理直接填埋会对环境造成严重的污染。市政污泥的综合利用能够使其得到科学、妥善的处置,并可以作为资源再次被我们利用,同时可以带来一定的经济价值。某科研团队利用市政污泥回收皓矾(ZnSO4·7H2O)的工艺流程如下:

已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有_______ (任写一条)。
(2)“一系列操作”主要包括_______ 、_______ 、过滤、洗涤,干燥。
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为_______ 。
(4)“浸渣”中含有Ag2S,经一系列处理得Ag(NH3)2Cl(可溶于水,电离成[Ag(NH3)2]+和Cl-},用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:_______ ,则反应中氧化剂与还原剂的物质的量之比为_______ 。
(5)浸出液中含有Fe2+,“沉铁”步骤中发生反应的离子方程式为_______ 。

已知:“沉铁”时若pH过高,会产生具有较强吸附性的氢氧化铁胶状沉淀。回答下列问题:
(1)为提高“酸浸”效率,可采取的措施有
(2)“一系列操作”主要包括
(3)用锌粉除铜、镍时,先除去铜,然后分离再置换除镍,用锌粉直接置换速率极慢,目前采用“锑盐净化法”,即置换时在酸性含Ni2+溶液中同时加入锌粉和Sb2O3,得到金属Ni和Sb的混合物,该混合物可表示为NiSb,形成NiSb的离子方程式为
(4)“浸渣”中含有Ag2S,经一系列处理得Ag(NH3)2Cl(可溶于水,电离成[Ag(NH3)2]+和Cl-},用肼(N2H4)还原Ag(NH3)2Cl得到单质银,N2H4的氧化产物为N2,写出该反应的离子方程式:
(5)浸出液中含有Fe2+,“沉铁”步骤中发生反应的离子方程式为
您最近一年使用:0次
名校
3 . 利用锌灰(主要成分为ZnO,含有CuO、PbO、SiO2、FeO、Fe2O3等杂质)制备高纯ZnO的工艺流程如图:

下列说法错误的是

下列说法错误的是
| A.滤渣1的成分只有SiO2 |
| B.加入的试剂a可为Zn,目的是除去Cu2+ |
C.步骤1中发生反应的离子方程式为MnO +3Fe3++7H2O=3Fe(OH)3↓+MnO2↓+5H+ +3Fe3++7H2O=3Fe(OH)3↓+MnO2↓+5H+ |
| D.若取步骤3后的干燥滤饼11.2g煅烧,得到产品8.1g,则x=2 |
您最近一年使用:0次
2023-02-11更新
|
341次组卷
|
4卷引用:山东省济南市2022-2023学年高二下学期开学学情检测(期末考)化学试题
4 . 碱式硫酸锌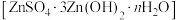 在动物饲料中常用作锌源添加剂。由锌冶炼中得到的白烟灰(主要成分为ZnO,还含有少量
在动物饲料中常用作锌源添加剂。由锌冶炼中得到的白烟灰(主要成分为ZnO,还含有少量 、PbO)制备碱式硫酸锌的一种工艺流程如图所示:
、PbO)制备碱式硫酸锌的一种工艺流程如图所示:

请回答下列问题:
(1)“浸出”工序中,ZnO溶于硫酸的化学方程式为_______ ;所得浸渣的主要成分为_______ (填化学式);该工序中应不断搅拌,目的是_______ 。
(2)“浸出”后砷元素以 形式存在,已知
形式存在,已知 为弱酸,则“除砷”时生成
为弱酸,则“除砷”时生成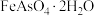 的离子方程式为
的离子方程式为_______ ;实际操作中消耗的 的量远高于理论值,原因为
的量远高于理论值,原因为_______ 。
(3)已知常温下 的
的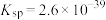 ,若在“除铁”时调节溶液
,若在“除铁”时调节溶液 ,
,_______ (填“能”或“不能”)使 完全沉淀(通常认为溶液中离子浓度小于
完全沉淀(通常认为溶液中离子浓度小于 为沉淀完全)。
为沉淀完全)。
(4)“工序X”的名称为_______ ; 的一种用途是
的一种用途是_______ 。
(5)“沉锌”时生成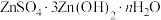 的化学方程式为
的化学方程式为_______ 。
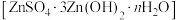 在动物饲料中常用作锌源添加剂。由锌冶炼中得到的白烟灰(主要成分为ZnO,还含有少量
在动物饲料中常用作锌源添加剂。由锌冶炼中得到的白烟灰(主要成分为ZnO,还含有少量 、PbO)制备碱式硫酸锌的一种工艺流程如图所示:
、PbO)制备碱式硫酸锌的一种工艺流程如图所示:
请回答下列问题:
(1)“浸出”工序中,ZnO溶于硫酸的化学方程式为
(2)“浸出”后砷元素以
 形式存在,已知
形式存在,已知 为弱酸,则“除砷”时生成
为弱酸,则“除砷”时生成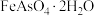 的离子方程式为
的离子方程式为 的量远高于理论值,原因为
的量远高于理论值,原因为(3)已知常温下
 的
的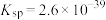 ,若在“除铁”时调节溶液
,若在“除铁”时调节溶液 ,
, 完全沉淀(通常认为溶液中离子浓度小于
完全沉淀(通常认为溶液中离子浓度小于 为沉淀完全)。
为沉淀完全)。(4)“工序X”的名称为
 的一种用途是
的一种用途是(5)“沉锌”时生成
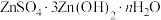 的化学方程式为
的化学方程式为
您最近一年使用:0次
解题方法
5 . 下列反应的描述与相关反应方程式均正确的是
| A.锌片插入硝酸银溶液中,有银析出:Zn +Ag+= Zn2++Ag |
| B.常温下,新切开的钠的光亮表面很快变暗:2Na + O2 = Na2O2 |
| C.将盐酸加入到氢氧化铜浊液中,无明显现象:Cu(OH)2+2H+= Cu2++2H2O |
D.碳酸氢钠溶液和氢氧化钠溶液混合,无明显现象: +OH-= +OH-= +H2O +H2O |
您最近一年使用:0次
6 . 回答下列问题。
(1)称取 进行热重分析,化合物质量随温度的变化关系如图所示,为获得
进行热重分析,化合物质量随温度的变化关系如图所示,为获得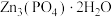 和
和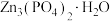 的混合产品,烘干时的温度范围为
的混合产品,烘干时的温度范围为__________ (填字母).
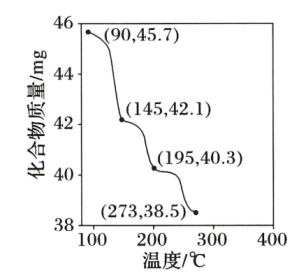
a. b.
b. c.
c. d.
d.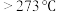
(2)为测定产品中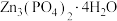 的含量,进行如下实验,已知滴定过程中
的含量,进行如下实验,已知滴定过程中 与
与 按
按 反应.
反应.
步骤Ⅰ:准确称取 产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至
产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至 容量瓶,定容。
容量瓶,定容。
步骤Ⅱ:移取 上述溶液于锥形瓶中,加入指示剂,在
上述溶液于锥形瓶中,加入指示剂,在 的缓冲溶液中用
的缓冲溶液中用 标准溶液滴定至终点,测得
标准溶液滴定至终点,测得 标准溶液的用量为
标准溶液的用量为 。
。
步骤Ⅱ中移取溶液时所使用的玻璃仪器为__________ ;
产品中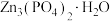 的质量分数为
的质量分数为_________ 。
下列操作中,导致产品中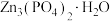 含量测定值偏低的是
含量测定值偏低的是_________ (填字母)。
a.步骤Ⅰ中定容时俯视刻度线
b.步骤Ⅰ中转移溶液时未洗涤烧杯
c.步骤Ⅰ中滴定管未用 标准溶液润洗
标准溶液润洗
d.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
(1)称取
 进行热重分析,化合物质量随温度的变化关系如图所示,为获得
进行热重分析,化合物质量随温度的变化关系如图所示,为获得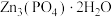 和
和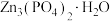 的混合产品,烘干时的温度范围为
的混合产品,烘干时的温度范围为
a.
 b.
b. c.
c. d.
d.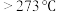
(2)为测定产品中
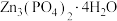 的含量,进行如下实验,已知滴定过程中
的含量,进行如下实验,已知滴定过程中 与
与 按
按 反应.
反应.步骤Ⅰ:准确称取
 产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至
产品于烧杯中,加入适量盐酸使其溶解,将溶液转移至 容量瓶,定容。
容量瓶,定容。步骤Ⅱ:移取
 上述溶液于锥形瓶中,加入指示剂,在
上述溶液于锥形瓶中,加入指示剂,在 的缓冲溶液中用
的缓冲溶液中用 标准溶液滴定至终点,测得
标准溶液滴定至终点,测得 标准溶液的用量为
标准溶液的用量为 。
。步骤Ⅱ中移取溶液时所使用的玻璃仪器为
产品中
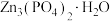 的质量分数为
的质量分数为下列操作中,导致产品中
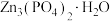 含量测定值偏低的是
含量测定值偏低的是a.步骤Ⅰ中定容时俯视刻度线
b.步骤Ⅰ中转移溶液时未洗涤烧杯
c.步骤Ⅰ中滴定管未用
 标准溶液润洗
标准溶液润洗d.步骤Ⅱ中滴定前滴定管内无气泡,滴定结束后有气泡
您最近一年使用:0次
22-23高二上·江苏南通·期末
名校
7 . 以含锌废渣(主要成分为 ,另含少量
,另含少量 、
、 、
、 等)为原料可生产草酸锌晶体(
等)为原料可生产草酸锌晶体(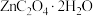 ,微溶于水),其工艺流程为:
,微溶于水),其工艺流程为:

常温时,部分金属离子开始沉淀及沉淀完全的 如下表所示(浓度
如下表所示(浓度 时可认为金属离子沉淀完全):
时可认为金属离子沉淀完全):
(1)酸浸时应适当增大盐酸的浓度,原因是_______ 和_______ 。
(2)氧化时反应的离子方程式为_______ 。
(3)为不引入杂质,物质X可以是_______ (填化学式)。
(4)“调 ”时应控制溶液的
”时应控制溶液的 范围是
范围是_______ 。
(5)将过滤II所得滤液与草酸钠 溶液按一定方式混合,可析出草酸锌晶体。
溶液按一定方式混合,可析出草酸锌晶体。
①滤液与草酸钠溶液混合方式不正确,会生成杂质沉淀。则滤液与草酸钠溶液的正确混合方式为_______ 。
②若将草酸钠换成草酸铵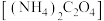 溶液,则不同的混合方式均不会生成杂质沉淀,原因是
溶液,则不同的混合方式均不会生成杂质沉淀,原因是_______ 。
(6)根据表格数据可知常温下,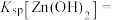
_______ 。
 ,另含少量
,另含少量 、
、 、
、 等)为原料可生产草酸锌晶体(
等)为原料可生产草酸锌晶体(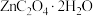 ,微溶于水),其工艺流程为:
,微溶于水),其工艺流程为:
常温时,部分金属离子开始沉淀及沉淀完全的
 如下表所示(浓度
如下表所示(浓度 时可认为金属离子沉淀完全):
时可认为金属离子沉淀完全):| 沉淀 | 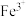 |  |  |  |
开始沉淀时的 |  | 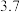 | 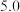 | 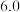 |
恰好完全沉淀时的 |  |  | 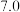 |  |
(1)酸浸时应适当增大盐酸的浓度,原因是
(2)氧化时反应的离子方程式为
(3)为不引入杂质,物质X可以是
(4)“调
 ”时应控制溶液的
”时应控制溶液的 范围是
范围是(5)将过滤II所得滤液与草酸钠
 溶液按一定方式混合,可析出草酸锌晶体。
溶液按一定方式混合,可析出草酸锌晶体。①滤液与草酸钠溶液混合方式不正确,会生成杂质沉淀。则滤液与草酸钠溶液的正确混合方式为
②若将草酸钠换成草酸铵
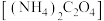 溶液,则不同的混合方式均不会生成杂质沉淀,原因是
溶液,则不同的混合方式均不会生成杂质沉淀,原因是(6)根据表格数据可知常温下,
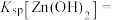
您最近一年使用:0次
8 . 纳米ZnS具有独特的光电效应。以工业废渣锌灰(主要成分为Zn、ZnO,还含有 、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
 、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下:
、FeO、CuO等杂质)为原料制备纳米ZnS的工业流程如下: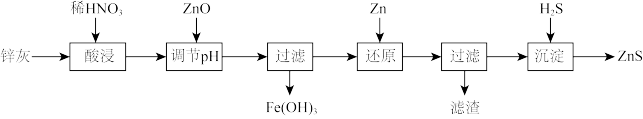
A.“酸浸”时FeO反应的离子方程式为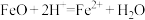 |
B.“还原”的目的是将 转化为 转化为 |
C.“沉淀”的离子方程式为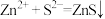 |
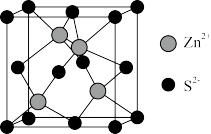
D.ZnS晶胞(如图所示)中每个 周围距离最近的 周围距离最近的 有4个 有4个 |
您最近一年使用:0次
2023-01-17更新
|
556次组卷
|
4卷引用:天津市河北区2022-2023学年高三上学期期末考试化学试题
天津市河北区2022-2023学年高三上学期期末考试化学试题(已下线)江苏省南通市如皋市2022-2023学年高三上学期1月期末考试化学试题江苏省扬州市广陵区红桥高级中学2023-2024学年高二下学期3月月考化学试题河北省张家口市张北县第一中学2023-2024学年高二下学期期中阶段测试化学试题
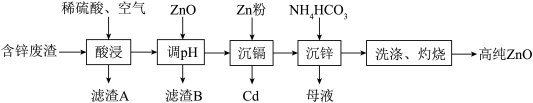
9 . ZnO是一种常用的化学添加剂,广泛应用于塑料、合成橡胶的化工生产中。一种以工业含锌废渣(主要成分为ZnO,还含有 、
、 、
、 及
及 等)制取氧化锌的工艺流程如图所示:
等)制取氧化锌的工艺流程如图所示:
已知:相关金属离子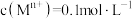 生成氢氧化物沉淀的pH如表所示:
生成氢氧化物沉淀的pH如表所示:
回答下列问题:
(1)“酸浸”时为了提高浸取速率,可以采取的措施是_______ (任写一种);该步骤中通入过量空气的作用是_______ 。
(2)滤渣B的主要成分为_______ ;“调pH”步骤时,应调节pH的范围是_______ ;若溶液碱性过强,可能导致的后果是_______ 。
(3)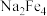 一种重要的净水剂,其基本原理是制得氢氧化铁,再将氢氧化铁与NaClO、烧碱在40℃反应,即可制备
一种重要的净水剂,其基本原理是制得氢氧化铁,再将氢氧化铁与NaClO、烧碱在40℃反应,即可制备 ,其中NaClO被还原成NaCl,请写出此法制备
,其中NaClO被还原成NaCl,请写出此法制备 的化学方程式:
的化学方程式:_______ 。
(4) 所含化学键的情况是
所含化学键的情况是_______ (填序号)。
①只含离子键 ②只含共价键 ③既有离子键,又有共价键
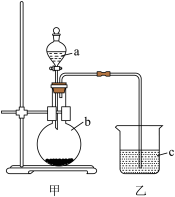
(5)Na、N、O三种元素形成的简单离子,半径由大到小的顺序是_______ (离子符号)。利用下图装置可比较C、N两元素的非金属性,b中发生反应的化学方程式为_______ 。
(6)碲(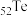 )的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O元素同主族,则碲及其化合物可能具有的性质为_______(填标号)。
)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O元素同主族,则碲及其化合物可能具有的性质为_______(填标号)。
 、
、 、
、 及
及 等)制取氧化锌的工艺流程如图所示:
等)制取氧化锌的工艺流程如图所示:
已知:相关金属离子
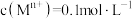 生成氢氧化物沉淀的pH如表所示:
生成氢氧化物沉淀的pH如表所示: |  |  |  |  | |
| 开始沉淀 | 6.5 | 2.7 | 3.4 | 6.5 | 7.4 |
| 沉淀完全 | 9.7 | 3.7 | 4.7 | 8.5 | 9.4 |
回答下列问题:
(1)“酸浸”时为了提高浸取速率,可以采取的措施是
(2)滤渣B的主要成分为
(3)
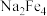 一种重要的净水剂,其基本原理是制得氢氧化铁,再将氢氧化铁与NaClO、烧碱在40℃反应,即可制备
一种重要的净水剂,其基本原理是制得氢氧化铁,再将氢氧化铁与NaClO、烧碱在40℃反应,即可制备 ,其中NaClO被还原成NaCl,请写出此法制备
,其中NaClO被还原成NaCl,请写出此法制备 的化学方程式:
的化学方程式:(4)
 所含化学键的情况是
所含化学键的情况是①只含离子键 ②只含共价键 ③既有离子键,又有共价键
(5)Na、N、O三种元素形成的简单离子,半径由大到小的顺序是

(6)碲(
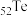 )的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O元素同主族,则碲及其化合物可能具有的性质为_______(填标号)。
)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下记录、储存信号。已知碲与O元素同主族,则碲及其化合物可能具有的性质为_______(填标号)。| A.单质碲在常温下是固体 | B.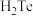 比 比 稳定 稳定 |
C.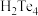 的酸性比 的酸性比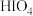 弱 弱 | D. 通入 通入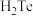 溶液中不发生反应 溶液中不发生反应 |
您最近一年使用:0次
名校
解题方法
10 . 铜转炉烟灰含金属元素(主要为 Cu、Zn、Pb、Fe)的硫酸盐和氧化物以及 SiO2.其有价金属回收工艺流程如下。已知:25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。回答下列问题:
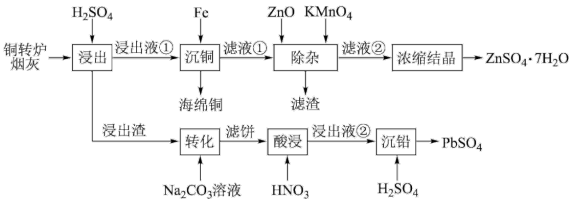
(1)“浸出液①”中所含有的金属阳离子有_______ 和Fe2+、Fe3+。“浸出”中,当硫酸浓度大于1.8mol·L−1时,金属离子浸出率反而下降,原因是_______ 。
(2)“除杂”中,加入ZnO调pH至5.2后,用KMnO4溶液氧化后,所得滤渣主要成分为Fe(OH)3、MnO2,该氧化过程的离子方程式为_______ 。
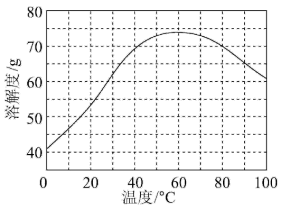
(3)ZnSO4的溶解度随温度变化曲线如图所示。“浓缩结晶”的具体操作步骤为:
①在沸腾时蒸发至溶液出现晶膜,停止加热;
②降温至 60℃蒸发至溶液出现晶膜,停止加热;
③冷却至室温,过滤、洗涤、干燥。
其中,步骤①的目的为_______ 。
(4)“转化”后,滤饼的主要成分是SiO2和_______ 。
(5)该工艺中,可循环利用的物质是_______ 。
(6)蓄电池如果一直闲置不使用,也会损耗电量,这种现象称为蓄电池的自放电现象。铅酸蓄电池的负极在较高温度和较高浓度的硫酸中容易发生自放电现象,用化学方程式表示自放电的机理:_______ 。

(1)“浸出液①”中所含有的金属阳离子有
(2)“除杂”中,加入ZnO调pH至5.2后,用KMnO4溶液氧化后,所得滤渣主要成分为Fe(OH)3、MnO2,该氧化过程的离子方程式为
(3)ZnSO4的溶解度随温度变化曲线如图所示。“浓缩结晶”的具体操作步骤为:

①在沸腾时蒸发至溶液出现晶膜,停止加热;
②降温至 60℃蒸发至溶液出现晶膜,停止加热;
③冷却至室温,过滤、洗涤、干燥。
其中,步骤①的目的为
(4)“转化”后,滤饼的主要成分是SiO2和
(5)该工艺中,可循环利用的物质是
(6)蓄电池如果一直闲置不使用,也会损耗电量,这种现象称为蓄电池的自放电现象。铅酸蓄电池的负极在较高温度和较高浓度的硫酸中容易发生自放电现象,用化学方程式表示自放电的机理:
您最近一年使用:0次



