海洋中蕴含着丰富的化学元素,是人类资源的宝库。
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是___________ 。海带灰中含有的其他可溶性无机盐,是在___________ (从以上流程中选填实验操作名称)中实现与碘分离。上述实验流程中不需要用到的仪器是___________ (从下列图中选择,写出名称)。

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为___________ 。
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO ,必须使用的物质是
,必须使用的物质是___________ (填序号)。
①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:
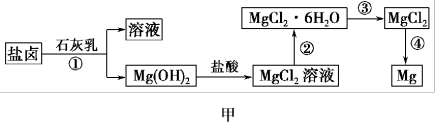
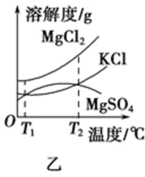
(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是___________ 。步骤③的具体操作为___________ 。
(5)写出步骤④制备金属镁的化学方程式:___________ 。该过程得到的镁蒸气需要在特定的循环中冷却,可选用___________ (填字母)作冷却剂。
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
I.某学校兴趣小组在实验室按如下实验流程提取海带中的碘。

(1)海带灼烧的目的是

(2)“氧化”时加入3mol·L-1H2SO4和3%H2O2溶液,发生反应的离子方程式为
(3)加碘食盐中的碘以KIO3形式存在,证明食盐中存在IO
 ,必须使用的物质是
,必须使用的物质是①pH试纸 ②蓝色石蕊试纸 ③碘化钾淀粉试纸 ④蒸馏水 ⑤食醋 ⑥醇
Ⅱ.某学校兴趣小组从海水晒盐后的盐卤(含MgCl2、NaCl、KCl、MgSO4等)中模拟工业生产来提取镁,主要过程如图甲:

(4)图乙是盐卤中某些物质的溶解度曲线,将盐卤加热到T2℃以上,根据溶解度曲线,首先从盐卤中分离出来的晶体是

(5)写出步骤④制备金属镁的化学方程式:
A.Ar B.CO2 C.空气 D.O2 E.水蒸气
更新时间:2024-03-11 07:22:27
|
相似题推荐
解答题-实验探究题
|
较易
(0.85)
【推荐1】某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①碱式滴定管用蒸馏水洗净后,再用待测溶液润洗2~3次,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察_______ ;滴定终点时的现象为锥形瓶中的溶液由_______ ;
(2)该小组在步骤①中的错误是_______ ,由此造成的测定结果_______ (填“偏高”或“偏低”或“无影响”);
(3)步骤②缺少的操作是_______ ,由此造成的测定结果_______ (填“偏高”或“偏低”或“无影响”);
(4)若滴定前平视,滴定终了俯视,使滴定结果_______ ,若酸式滴定管滴定前尖嘴部分有气泡,滴定终了没有气泡使滴定结果_______ (填“偏高”或“偏低”或“无影响”);
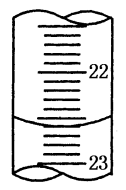
(5)如图是某次滴定时的滴定管中的液面,其读数为_______ mL;
(6)根据下列数据:
请计算待测烧碱溶液的物质的量浓度_______ 。(请写出解答过程)
①碱式滴定管用蒸馏水洗净后,再用待测溶液润洗2~3次,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,用待测溶液润洗锥形瓶2~3次;从碱式滴定管中放出25.00mL待测溶液到锥形瓶中。
②酸式滴定管用蒸馏水洗净后,立即向其中注入0.1000mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于“0”刻度以下的位置,记下读数。
③向锥形瓶中滴入酚酞作指示剂,进行滴定。滴定至终点,测得所耗盐酸的体积为V1mL。
④重复以上过程,但在滴定过程中向锥形瓶中加入5mL的蒸馏水,测得所耗盐酸的体积为V2mL。
试回答下列问题:
(1)滴定时边滴边摇动锥形瓶,眼睛应观察
(2)该小组在步骤①中的错误是
(3)步骤②缺少的操作是
(4)若滴定前平视,滴定终了俯视,使滴定结果
(5)如图是某次滴定时的滴定管中的液面,其读数为

(6)根据下列数据:
| 测定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数/mL | 滴定后读数/mL | ||
| 第一次 | 25.00 | 0.40 | 20.38 |
| 第二次 | 25.00 | 4.00 | 24.02 |
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
解题方法
【推荐2】某学生用0.1200mol/LNaOH溶液测定某未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是用序号字母填写:__ →__ →F→__ →__ →__ →D。
(2)操作F中应该选择图中滴定管___ 填标号。

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察__ 。
(4)滴定结果如表所示:
计算该盐酸的物质的量浓度为__ (精确至0.001)。
(5)下列操作会导致测定结果偏高的是__ 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
Ⅰ、写出用KMnO4滴定H2C2O4的离子方程式__ 。
Ⅱ、判断滴定终点的方法是__
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是用序号字母填写:
(2)操作F中应该选择图中滴定管

(3)滴定时边滴边摇动锥形瓶,眼睛应注意观察
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积 | 标准溶液的体积 | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 0.60 | 20.60 |
| 3 | 25.00 | 0.20 | 20.19 |
(5)下列操作会导致测定结果偏高的是
A.碱式滴定管在装液前未用标准NaOH溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.碱式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(6)氧化还原滴定实验与酸碱中和滴定类似用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。测血钙的含量时,进行如下实验:
①可将2mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
Ⅰ、写出用KMnO4滴定H2C2O4的离子方程式
Ⅱ、判断滴定终点的方法是
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
解题方法
【推荐3】某学生用0.1000mol/L NaOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
A.用蒸馏水洗干净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20. 00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm
处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,
瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)___ →___ → B → C →___ →___ →___ 。
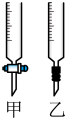
(2)操作F中应该选择图中______ 滴定管(填标号)。
(3)滴定时边滴边摇动锥形瓶,眼睛应观察________ 。
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是_________________________________ 。
(4)滴定结果如表所示:
滴定中误差较大的是第________ 次实验,造成这种误差的可能原因是_________ 。
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.达到滴定终点时,俯视溶液凹液面最低点读数
C.滴定过程中锥形瓶溶液局部有颜色变化即停止滴加
D.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为________ mol/L。
(6)如果准确移取20. 00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?________ (填“是”或“否”)。
A.用蒸馏水洗干净滴定管
B.用待测定的溶液润洗酸式滴定管
C.用酸式滴定管取稀盐酸20. 00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作一次
E.检查滴定管是否漏水
F.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管“0”刻度以上2~3 cm
处,再把碱式滴定管固定好,调节液面至“0”刻度或“0”刻度以下
G.把锥形瓶放在滴定管下面,
瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度.
完成以下填空:
(1)正确操作的顺序是(用序号字母填写)
(2)操作F中应该选择图中

(3)滴定时边滴边摇动锥形瓶,眼睛应观察
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
滴定终点溶液颜色的变化是
(4)滴定结果如表所示:
| 滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | |||
| 1 | 20 | 1.02 | 21.02 | |
| 2 | 20 | 2.00 | 25.00 | |
| 3 | 20 | 0.60 | 20.60 | |
A.碱式滴定管在装液前未用标准NaOH溶液润洗2~3次
B.达到滴定终点时,俯视溶液凹液面最低点读数
C.滴定过程中锥形瓶溶液局部有颜色变化即停止滴加
D.滴定开始前碱式滴定管尖嘴部分有气泡,在滴定终点读数时未发现气泡
E.滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
(5)该盐酸的浓度为
(6)如果准确移取20. 00mL 0.1000mol/L NaOH溶液于锥形瓶中,滴入酚酞指示剂,然后用未知浓度的盐酸(装在酸式滴定管中)滴定,是否也可测定出盐酸的物质的量浓度?
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐1】海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
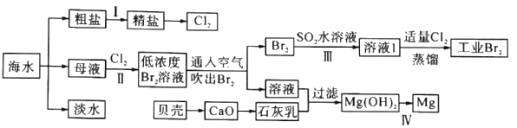
请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:_________________________ 。
(2)海水提溴,制得1molBr2至少需要消耗_________ molCl2。步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关反应的离子方程式为_________ 。
(3)用四氯化碳可以将生成的溴提取出来,利用了溴的________ 性质,为了除去产物中残留的少量Cl2,可向其中加入_________ 溶液。

请回答下列问题:
(1)步骤I中,粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,粗盐精制过程中要使用Na2CO3溶液,请写出加入Na2CO3溶液后相关化学反应的离子方程式:
(2)海水提溴,制得1molBr2至少需要消耗
(3)用四氯化碳可以将生成的溴提取出来,利用了溴的
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐2】海洋资源的利用具有广阔前景。
(1)无需经过化学变化就能从海水中获得的物质是_______(填序号)
(2)下图是从海水中提取粗溴的主要流程

①从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是_______ 。
②可用热空气吹出溴是因为溴的_______ (选填编号)
A.熔点较低 B.熔点较高 C.沸点较低 D.沸点较高
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
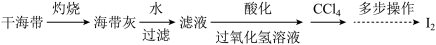
①灼烧海带至灰烬时所用的主要仪器名称是_______ 。
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式_______ 。反应结束后,再加入CCl4作萃取剂,振荡、静置,该步操作用到的仪器名称为_______ ,可以观察到CCl4层呈_______ 色。
(1)无需经过化学变化就能从海水中获得的物质是_______(填序号)
| A.Cl2 | B.淡水 | C.烧碱 | D.食盐 |

①从海水中提取溴的主要步骤是向浓缩的海水中通入氯气,将溴离子氧化,该反应的离子方程式是
②可用热空气吹出溴是因为溴的
A.熔点较低 B.熔点较高 C.沸点较低 D.沸点较高
(3)海带灰中富含以I-形式存在的碘元素。实验室提取I2的途径如下所示:
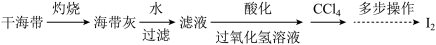
①灼烧海带至灰烬时所用的主要仪器名称是
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】海水是一个巨大的化学资源宝库。海水综合利用的部分工艺流程如图所示。
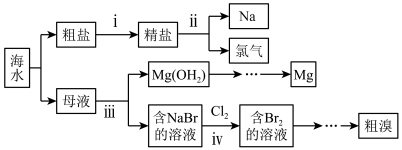
回答下列问题:
(1)步骤ⅰ中,可以通过沉淀法除去粗盐中的 、
、 和
和 ,选用的沉淀剂依次为过量的
,选用的沉淀剂依次为过量的 溶液、
溶液、_______ 溶液(填化学式,下同)、_______ 溶液,经过滤、加适量盐酸,蒸发结晶后获得精盐。
(2)步骤ⅱ制得的金属钠很不稳定,暴露在空气中极易和氧气发生化学反应,生成_______ (填化学式);氯气与石灰乳反应可制得漂白粉,漂白粉的漂白原理是_______ (用化学方程式表示)。
(3)步骤ⅲ中分离 与含NaBr的溶液的操作名称是
与含NaBr的溶液的操作名称是_______ ,在实验室中进行该操作需要的玻璃仪器有烧杯、玻璃棒和_______ ; 通过一系列操作最后获得无水
通过一系列操作最后获得无水 ,写出由
,写出由 制取Mg的化学方程式
制取Mg的化学方程式_______ 。
(4)写出步骤ⅳ主要反应的离子方程式_______ 。

回答下列问题:
(1)步骤ⅰ中,可以通过沉淀法除去粗盐中的
 、
、 和
和 ,选用的沉淀剂依次为过量的
,选用的沉淀剂依次为过量的 溶液、
溶液、(2)步骤ⅱ制得的金属钠很不稳定,暴露在空气中极易和氧气发生化学反应,生成
(3)步骤ⅲ中分离
 与含NaBr的溶液的操作名称是
与含NaBr的溶液的操作名称是 通过一系列操作最后获得无水
通过一系列操作最后获得无水 ,写出由
,写出由 制取Mg的化学方程式
制取Mg的化学方程式(4)写出步骤ⅳ主要反应的离子方程式
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
【推荐1】碘是人体必需的元素之一,海洋植物如海带、海藻中含有丰富的碘元素。沿海地区居民常食用海带,因此,甲状腺肿大等碘缺乏病发病率低。已知,碘元素以碘离子的形式存在,常温下I-能被氯水氧化为I2;I2在有机溶剂中的溶解度明显大于在水中的溶解度;I2有颜色,而I-无颜色。实验室里从海藻中提取碘的流程如图所示:

(1)写出A的化学式______________ 。
(2)步骤③操作所需要的玻璃仪器是______________ 、______________ 、__________________ 。
(3)下列有机溶剂中不可作为溶剂G的有________ (填下面的序号)。
A.酒精 B.四氯化碳 C.乙酸 D.汽油 E.苯
(4)步骤⑤的操作名称是__________ 、分液;溶液E的颜色比溶液F的颜色______ (填“深”或“浅”)。
(5)步骤⑤中,若选用(3)中的__________ (填溶液名称)为溶剂G,分液时,应先把溶液____ (填“E”或“F”)从分液漏斗的下部排出,之后,再把另一溶液从分液漏斗的上口倒出。

(1)写出A的化学式
(2)步骤③操作所需要的玻璃仪器是
(3)下列有机溶剂中不可作为溶剂G的有
A.酒精 B.四氯化碳 C.乙酸 D.汽油 E.苯
(4)步骤⑤的操作名称是
(5)步骤⑤中,若选用(3)中的
您最近半年使用:0次
解答题-实验探究题
|
较易
(0.85)
名校
【推荐2】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋植物植物中提取碘的流程如图:

某化学兴趣小组将上述流程②③设计成如图所示:

已知氯水中含有Cl2,②中发生反应的化学方程式为Cl2+2KI=2KCl+I2。
回答下列问题:
(1)写出提取过程①③中实验操作的名称:①_____ ,③_____ 。
(2)四氯化碳是_____ 色、比水_____ 的液体。F中下层液体的颜色为______ 色,上层液体中溶质的主要成分为_____ 。
(3)从F中得到固态碘还需进行的操作是______ 。
(4)在灼烧过程中,将使用到的(除泥三角外)实验仪器有( )
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯

某化学兴趣小组将上述流程②③设计成如图所示:

已知氯水中含有Cl2,②中发生反应的化学方程式为Cl2+2KI=2KCl+I2。
回答下列问题:
(1)写出提取过程①③中实验操作的名称:①
(2)四氯化碳是
(3)从F中得到固态碘还需进行的操作是
(4)在灼烧过程中,将使用到的(除泥三角外)实验仪器有
A.试管 B.瓷坩埚 C.坩埚钳 D.蒸发皿 E.酒精灯
您最近半年使用:0次
解答题-工业流程题
|
较易
(0.85)
解题方法
【推荐3】海带中含有碘元素。从海带中提取碘的实验过程如下图所示:
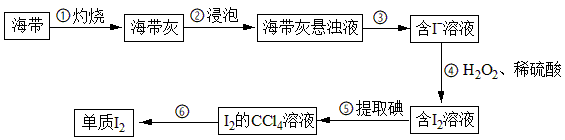
(1)实验步骤①会用到下列仪器中的____________ (填字母)。
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤③的操作名称是_______ 。
(3)步骤④中反应的离子方程式为_________ 。
(4)请设计一种检验水溶液中是否含有碘单质的方法:______ 。
(5)海带灰中含有的硫酸盐、碳酸盐等,在实验步骤________ (填序号)中实现与碘分离。

(1)实验步骤①会用到下列仪器中的
a.酒精灯 b.漏斗 c.坩埚 d.泥三角
(2)步骤③的操作名称是
(3)步骤④中反应的离子方程式为
(4)请设计一种检验水溶液中是否含有碘单质的方法:
(5)海带灰中含有的硫酸盐、碳酸盐等,在实验步骤
您最近半年使用:0次



