铝是典型的两性金属,既能与酸反应,又能与强碱溶液反应。回答下列问题:
(1)在铝分别与盐酸和氢氧化钠溶液的反应中,铝元素化合价的变化都是___________ (升高/降低),还原剂都是___________ 。
(2)1mol的铝分别与足量的稀盐酸和氢氧化钠溶液反应,生成氢气的体积在相同状况下比值为___________ ,消耗氯化氢和氢氧化钠的物质的量之比为___________ 。
甲、乙两个烧杯中分别盛有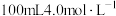 的盐酸和
的盐酸和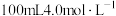 氢氧化钠溶液,向两个烧杯中都加入5.4g铝粉,在相同状况下产生气体的体积比为
氢氧化钠溶液,向两个烧杯中都加入5.4g铝粉,在相同状况下产生气体的体积比为___________ 。反应中消耗的NaOH与HCl的物质的量之比为___________ 。
(1)在铝分别与盐酸和氢氧化钠溶液的反应中,铝元素化合价的变化都是
(2)1mol的铝分别与足量的稀盐酸和氢氧化钠溶液反应,生成氢气的体积在相同状况下比值为
甲、乙两个烧杯中分别盛有
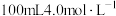 的盐酸和
的盐酸和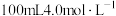 氢氧化钠溶液,向两个烧杯中都加入5.4g铝粉,在相同状况下产生气体的体积比为
氢氧化钠溶液,向两个烧杯中都加入5.4g铝粉,在相同状况下产生气体的体积比为
更新时间:2024-04-29 10:18:16
|
相似题推荐
计算题
|
适中
(0.65)
名校
【推荐1】将一定质量的Al、Mg混合物加入到足量的盐酸中,充分反应后得到标准状况下的氢气8.96L;如果将等质量的该混合物加入到足量的NaOH溶液中,充分反应后得到标准状况下的氢气6.72L。
(1)混合物与NaOH溶液反应的离子方程式为______________________ ;
(2)求混合物中各成分的质量______ 。(写出计算过程)
(1)混合物与NaOH溶液反应的离子方程式为
(2)求混合物中各成分的质量
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】I.(1)氨和硝酸都是重要的工业原料,标准状况下,将640L氨气溶于水形成1L氨水,则此氨水的物质的量浓度为______ mol/L(保留三位有效数字).将体积为12mL的试管充满NO2气体后,倒立于水槽中(保持同温同压),液面稳定后,保持相同条件下再通入O2,若要液面仍在原来的位置,则通入O2的体积为______ mL。
(2)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH- =NO2-+NO3-+H2O和NO+NO2+2OH- =_____ +H2O(配平该方程式)。
Ⅱ.在标准状况下,分别取30mL相同浓度的盐酸依次装入①②③试管中,然后分别慢慢加入组成相同的镁铝混合物,相同条件下,测得有关数据如表所示(反应前后溶液体积不发生变化)。
(1)①组实验中,盐酸__________ ,(填过量或不足);②组实验中,盐酸__________ ,(填过量或不足)。
(2)盐酸的物质的量浓度为__________ mol/L。
(3)混合物中Mg和Al的物质的量之比为__________ 。
(2)工业中的尾气(假设只有NO和NO2)用烧碱进行吸收,反应的离子方程式为2NO2+2OH- =NO2-+NO3-+H2O和NO+NO2+2OH- =
Ⅱ.在标准状况下,分别取30mL相同浓度的盐酸依次装入①②③试管中,然后分别慢慢加入组成相同的镁铝混合物,相同条件下,测得有关数据如表所示(反应前后溶液体积不发生变化)。
| 实验序号 | ① | ② | ③ |
| 混合物质量/mg | 255 | 510 | 1020 |
| 气体体积/mL | 280 | 336 | 336 |
(1)①组实验中,盐酸
(2)盐酸的物质的量浓度为
(3)混合物中Mg和Al的物质的量之比为
您最近一年使用:0次
【推荐1】(1)在同温同压下,同体积的气体甲烷(CH4)和二氧化碳密度之比为_________ 。
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1mol•L-1,SO42-的物质的量浓度为0.3mol•L-1,则混合液中K+的物质的量浓度为______________ mol•L-1 。
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:__________ 。
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是___ mol;用单线桥标出电子转移的方向和数目。___
(2)在K2SO4和Fe2(SO4)3的混合溶液中,Fe3+的物质的量浓度为0.1mol•L-1,SO42-的物质的量浓度为0.3mol•L-1,则混合液中K+的物质的量浓度为
(3)将铝粉加入氢氧化钠溶液中,写出该反应的离子方程式:
(4)用KMnO4氧化盐酸溶液,反应方程式如下2KMnO4+16HCl===2KCl+2MnCl2+5Cl2↑+8H2O,若产生的Cl2在标准状况下体积为56 L,则反应中被氧化的HCl的物质的量是
您最近一年使用:0次
计算题
|
适中
(0.65)
名校
【推荐2】有三种镁铝合金样品(组分比例不一定相同)①、②、③。小奉、小贤、小红三同学各取一种样品,对合金中镁的质量分数进行下列实验探究:
(1)小奉取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为___________ 。(保留小数点后面2位)
(2)小贤取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m2的取值范围是_________ 。(结果转化为最简分数)
(3)小红取不同质量的样品③分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下所示:
求:I.盐酸的物质的量浓度_______
II.合金中镁的质量分数_______
III.要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少mL_______ ?
(1)小奉取样品①m1 g和过量的氢氧化钠溶液反应,然后过滤;再往滤液中通入过量的二氧化碳气体,将所得沉淀过滤、洗涤、烘干、灼烧,得到固体质量仍为m1 g。则合金中镁的质量分数为
(2)小贤取样品②m2 g和足量的稀硫酸反应,发现固体完全溶解,标准状况下得到气体体积为VL,则m2的取值范围是
(3)小红取不同质量的样品③分别和30 mL同浓度的盐酸反应,所取合金质量与产生气体的体积(标准状况下测定)如下所示:
| 实验序号 | a | b | c |
| 合金质量(g) | 0.51 | 0.765 | 0.918 |
| 气体体积(mL) | 560 | 672 | 672 |
求:I.盐酸的物质的量浓度
II.合金中镁的质量分数
III.要使c组实验后剩余合金中的铝恰好完全溶解,还需向容器中加入1.0 mol/L的氢氧化钠溶液多少mL
您最近一年使用:0次

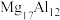 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为
)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为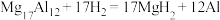 。得到的混合物Y(
。得到的混合物Y( )在一定条件下释放出氢气。在
)在一定条件下释放出氢气。在 溶液中,混合物Y能完全释放出
溶液中,混合物Y能完全释放出 。
。 完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出
完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出

