石墨烯是从石墨材料中剥离出来,由碳原子组成的只有一层原子厚度的二维晶体,其部分性能优于传统的硅材料,具有广泛的应用前景。
(1)石墨烯加氢完全制得的石墨烷可用 表示。它的结构相当于在不破坏石墨烯独特的六边形晶格结构和单原子厚度的情况下,给每个碳原子上都增加了一个氢原子。下列有关石墨烷的叙述正确的是
表示。它的结构相当于在不破坏石墨烯独特的六边形晶格结构和单原子厚度的情况下,给每个碳原子上都增加了一个氢原子。下列有关石墨烷的叙述正确的是_______ (填字母)。
a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
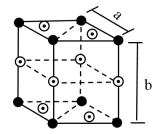
(2)石墨晶体由层状石墨“分子”按ABAB…方式堆积而成,如图所示,层与层之间靠_______ 维系。图中用虚线标出了石墨的一个六方晶胞。1个六方石墨晶胞中碳原子的个数为_______ ,D处碳原子的分数坐标为 ,则E处碳原子的分数坐标为
,则E处碳原子的分数坐标为_______ (以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,各原子的位置称作原子的分数坐标)。_______ ,晶体中Si原子与 键的数目之比为
键的数目之比为_______ 。
(4)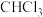 与
与 结构相似,分子的空间结构为
结构相似,分子的空间结构为________ ,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体单质,写出该反应的化学方程式:_______ 。
(1)石墨烯加氢完全制得的石墨烷可用
 表示。它的结构相当于在不破坏石墨烯独特的六边形晶格结构和单原子厚度的情况下,给每个碳原子上都增加了一个氢原子。下列有关石墨烷的叙述正确的是
表示。它的结构相当于在不破坏石墨烯独特的六边形晶格结构和单原子厚度的情况下,给每个碳原子上都增加了一个氢原子。下列有关石墨烷的叙述正确的是a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
(2)石墨晶体由层状石墨“分子”按ABAB…方式堆积而成,如图所示,层与层之间靠
 ,则E处碳原子的分数坐标为
,则E处碳原子的分数坐标为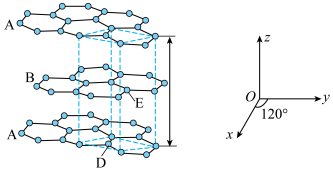
 键的数目之比为
键的数目之比为(4)
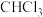 与
与 结构相似,分子的空间结构为
结构相似,分子的空间结构为
更新时间:2024-05-05 20:29:32
|
相似题推荐
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】回答下列问题:
(1)现有四种元素基态原子的电子排布式如下,则下列有关比较中正确的是____ 。
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
(2)氯仿CHCl3常因保存不慎而被氧化,产生剧毒物光气COCl2:2CHCl3+O2→2HCl+2COCl2,其中光气的结构式如图所示:

则每一个COCl2分子中含有____ 个σ键,中心C原子采取____ 杂化。
(3)Cr3+可与很多分子或离子形成配合物。
①KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为____ ;已知中心离子杂化时优先选择能量低的轨道参与杂化,使得配合物能量降低,物质更稳定,则该配合物中心离子杂化方式为d2sp3;晶体场理论认为,基态离子的d轨道存在未成对电子时,d电子发生d—d跃迁是金属阳离子在水溶液中显色的主要原因。试判断该配合物[Cr(NH3)6][Cr(SCN)6]是否有色____ (填“是”或“否”)。
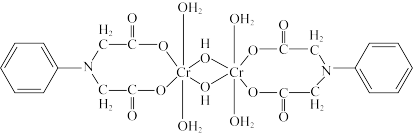
②Cr3+的一种配合物结构如图,配合物中Cr3+的配位数____ 。
(4)氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为____ ;设氮化锂晶体中,同层N—N间距为a pm,层与层间距为b pm,该物质的密度为____ g/cm3(用含a、b的式子表示)。

(1)现有四种元素基态原子的电子排布式如下,则下列有关比较中正确的是
①1s22s22p63s23p4②1s22s22p63s23p3③1s22s22p3④1s22s22p5
| A.第一电离能:④>③>①>② | B.原子半径:②>①>③>④ |
| C.电负性:④>①>③>② | D.最高正化合价:④>③>②>① |

则每一个COCl2分子中含有
(3)Cr3+可与很多分子或离子形成配合物。
①KSCN可制备配合物[Cr(NH3)6][Cr(SCN)6],该配合物中铬元素的化合价为
②Cr3+的一种配合物结构如图,配合物中Cr3+的配位数

(4)氮化锂晶体中存在锂、氮原子共同组成的锂、氮层,锂原子以石墨晶体中的碳原子方式排布,N原子处在六元环的中心,同层中锂、氮的原子个数比为


您最近一年使用:0次
【推荐2】自然界中氟多以化合态形式存在,主要有萤石(CaF2)、冰晶石(Na3AlF6)等
(1)基态氟原子中,有_______ 种能量不同的电子。
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是_________________ (用离子方程式表示)。(已知AlF63-在溶液中可稳定存在)
(3)BF3与一定量的水形成(H2O)2•BF3晶体Q,晶体Q在一定条件下可转化为R:

①晶体R中含有的化学键包括_________ (填标号)。
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为_________ ,阴离子中心原子的杂化方式为_________ 。
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是___________________________________ 。
(5)Na3AlF6晶胞结构如图所示:

①位于大立方体体心▽代表________ (填离子符号);
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为_______ ,其中_________ %正八面体空隙被Na+填充;
③晶胞边长为x nm,则相距最近的两个Na+之间距离为_____ nm;设Na3AlF6的相对分子质量为M,阿伏伽德罗常数为NA,则该晶体密度的计算表达式为________ g/cm3。
(1)基态氟原子中,有
(2)萤石(CaF2)难溶于水,但可溶于含Al3+的溶液中,原因是
(3)BF3与一定量的水形成(H2O)2•BF3晶体Q,晶体Q在一定条件下可转化为R:

①晶体R中含有的化学键包括
A.离子键 B.配位键 C.共价键 D.氢键
②R中阳离子的空间构型为
(4)F2与其他卤素单质反应可以形成卤素互化物,如ClF3、BrF3等。ClF3的熔沸点比BrF3的低,原因是
(5)Na3AlF6晶胞结构如图所示:

①位于大立方体体心▽代表
②AlF63-做面心立方最密堆积形成正四面体和正八面体两种空隙,正四面体空隙数和AlF63-数之比为
③晶胞边长为x nm,则相距最近的两个Na+之间距离为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐3】钠、钾、钛、镍、铅单质及其化合物在工业生产中有广泛的应用。
Ⅰ.回答下列问题:
(1)Ti3+的价电子排布图为___________ ;将某含钛试样溶解于强酸溶液中生成TiO2+,加入铝片将TiO2+转化为Ti3+,写出TiO2+转化为Ti3+的离子方程式___________ 。
(2)用I表示电离能,则I2(K)___________ I1(Ar) (填“大于”,“小于”,“等于”)。
(3)乙二胺四乙酸(俗名EDTA)结构如图所示是代表性的螯合剂,分子中可作为配位原子的是___________ (填元素符号)。EDTA可与Ni2+、Ca2+、Pb2+等离子形成配合物,可用Na2[Ca(EDTA)]治疗铅中毒,其离子方程式为___________ 。

Ⅱ.下面是一种简单可行的测定阿伏加德罗常数的步骤:
①固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
②用滴定管(如图)向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。

已知:滴定管是一种用来测量体积的精密仪器,整体材料均为玻璃,区别为活塞,酸式滴定管的活塞是玻璃材质,而碱式滴定管为橡胶(非极性高分子化合物)。请回答下列问题:
(4)步骤①中A仪器最好使用___________(填序号)。
(5)步骤②用___________ (填“酸式滴定管”或“碱式滴定管”),理由是___________ 。能否用水代替苯___________ ,理由是___________ 。
(6)已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如图),用上述测定方法测得的阿伏加德罗常数NA的表达式为___________ 。

Ⅰ.回答下列问题:
(1)Ti3+的价电子排布图为
(2)用I表示电离能,则I2(K)
(3)乙二胺四乙酸(俗名EDTA)结构如图所示是代表性的螯合剂,分子中可作为配位原子的是

Ⅱ.下面是一种简单可行的测定阿伏加德罗常数的步骤:
①固体NaCl细粒干燥后,准确称取mg NaCl固体并转移到定容仪器A中;
②用滴定管(如图)向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。

已知:滴定管是一种用来测量体积的精密仪器,整体材料均为玻璃,区别为活塞,酸式滴定管的活塞是玻璃材质,而碱式滴定管为橡胶(非极性高分子化合物)。请回答下列问题:
(4)步骤①中A仪器最好使用___________(填序号)。
| A.量筒 | B.烧杯 | C.容量瓶 | D.试管 |
(6)已知NaCl晶体中,靠得最近的Na+与Cl-间的平均距离为a cm(如图),用上述测定方法测得的阿伏加德罗常数NA的表达式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐1】(1)石墨晶体由层状石墨“分子”按ABAB方式堆积而成,如图甲所示,图中用虚线标出了石墨的一个晶胞.该晶胞中含有的碳原子数为__________ 。
甲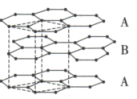 (石墨晶胞) 乙
(石墨晶胞) 乙 (石墨烯) 丙
(石墨烯) 丙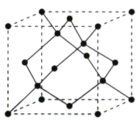 (金刚石晶胞) 丁
(金刚石晶胞) 丁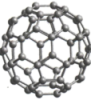 (
( )
)
(2)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图乙所示, 石墨烯中含有的六元环个数为
石墨烯中含有的六元环个数为___________ ,下列有关石墨烯的说法正确的是_________ (填序号)。
a.晶体中碳原子间全部是碳碳单键
b.石墨烯中所有碳原子处于同一个平面内
c.从石墨中剥离得到石墨烯需克服分子间作用力
(3)金刚石晶胞如图丙所示,则金刚石晶胞中原子的配位数为_________ ,原子空间利用率为_________ 。
(4)石墨烯可转化为 ,
, 的结构如图丁所示,该分子是由五边形和六边形碳环构成的球体,其中五边形碳环有12个,六边形碳环有
的结构如图丁所示,该分子是由五边形和六边形碳环构成的球体,其中五边形碳环有12个,六边形碳环有_______ 个。
甲
 (石墨晶胞) 乙
(石墨晶胞) 乙 (石墨烯) 丙
(石墨烯) 丙 (金刚石晶胞) 丁
(金刚石晶胞) 丁 (
( )
)(2)石墨烯是一种由单层碳原子构成的平面结构新型碳材料,如图乙所示,
 石墨烯中含有的六元环个数为
石墨烯中含有的六元环个数为a.晶体中碳原子间全部是碳碳单键
b.石墨烯中所有碳原子处于同一个平面内
c.从石墨中剥离得到石墨烯需克服分子间作用力
(3)金刚石晶胞如图丙所示,则金刚石晶胞中原子的配位数为
(4)石墨烯可转化为
 ,
, 的结构如图丁所示,该分子是由五边形和六边形碳环构成的球体,其中五边形碳环有12个,六边形碳环有
的结构如图丁所示,该分子是由五边形和六边形碳环构成的球体,其中五边形碳环有12个,六边形碳环有
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
【推荐2】磷及其化合物在工业生产中起着重要的作用。
(1)基态磷原子的价层电子排布式为_______ ,同周期元素中第一电离能和电负性均大于磷元素的是_______ (填元素符号)。
(2)磷元素有白磷、黑磷等常见的单质。
①白磷是分子晶体,分子结构如图 ,推测白磷
,推测白磷_______ (“能”或“否”)溶于 ,理由是
,理由是_______ 。
②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是_______ (填字母序号)

a.层与层之间的作用力是共价键
b.分子中磷原子杂化方式为 杂化
杂化
c.每个六元环平均占有2个p原子
(3)第ⅢA族元素的磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①
从结构角度说明上表中三种物质其熔点差异的原因_______ 。
②磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。三溴化磷分子的空间构型是_______ 磷化硼晶体晶胞如图所示,磷原子周围等距且最近的硼原子有_______ 个,已知该晶胞边长 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则磷化硼晶体的密度为
,则磷化硼晶体的密度为_______  。
。

(1)基态磷原子的价层电子排布式为
(2)磷元素有白磷、黑磷等常见的单质。
①白磷是分子晶体,分子结构如图
 ,推测白磷
,推测白磷 ,理由是
,理由是②黑磷晶体是一种比石墨烯更优秀的新型材料,其晶体是与石墨类似的层状结构,如下图所示。下列有关黑磷晶体的说法正确的是

a.层与层之间的作用力是共价键
b.分子中磷原子杂化方式为
 杂化
杂化c.每个六元环平均占有2个p原子
(3)第ⅢA族元素的磷化物均为共价化合物,被广泛用于高温技术、新型电子产品等领域。
①
| 物质 | 磷化铝(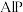 ) ) | 磷化镓(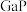 ) ) | 磷化铟( ) ) |
熔点/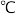 | 2000 | 1465 | 1070 |
从结构角度说明上表中三种物质其熔点差异的原因
②磷化硼是一种耐磨涂料,它可用作金属的表面保护层,磷化硼可由三溴化硼和三溴化磷于高温下在氢气中反应合成。三溴化磷分子的空间构型是
 ,阿伏加德罗常数为
,阿伏加德罗常数为 ,则磷化硼晶体的密度为
,则磷化硼晶体的密度为 。
。
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】碳元素是形成单质及其化合物种类最多的元素。回答下列问题:
(1)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵 转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是
转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是_______ ,写出与 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式_______ (写出一种物质即可)
(2)石墨烯(图a)是一种由单层碳原子构成的平面结构新型导电材料,具有大π共轭体系。石墨烯中部分碳原子被氧化后,其平面结构发生改变,转化为氧化石量烯(图b)。

图a中,1号C的杂化方式为_______ ,图b中键角α_______ 键角β (填“>”、“<”或“=”);若将图b所示的氧化石墨烯分散在 中,则氧化石墨烯中可与
中,则氧化石墨烯中可与 形成氢键的原子有
形成氢键的原子有_______ (填元素符号)。
(3)丁二酮肟与 生成鲜红色丁二酮肟镍沉淀(如图①),该反应可用于检验
生成鲜红色丁二酮肟镍沉淀(如图①),该反应可用于检验 。丁二酮肟镍中存在的化学键有
。丁二酮肟镍中存在的化学键有_______ (标号)。
A.配位键 B.氢键 C.金属键 D.范德华力 E.共价键

(4)碳的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图②所示,则其化学式可表示为_______ 。
(5)碳和钨(W)组成一种晶体,其熔点为2870℃,硬度接近金刚石,其晶胞结构如图所示,则其化学式为_______ 。

(1)碳元素是组成有机物必不可少的元素。1828年,化学家维勒首次用加热的方法将无机物氰酸铵
 转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是
转化为有机物尿素,开启了人造有机物的大门。氰酸铵中阳离子的立体构型是 互为等电子体的微粒的化学式
互为等电子体的微粒的化学式(2)石墨烯(图a)是一种由单层碳原子构成的平面结构新型导电材料,具有大π共轭体系。石墨烯中部分碳原子被氧化后,其平面结构发生改变,转化为氧化石量烯(图b)。

图a中,1号C的杂化方式为
 中,则氧化石墨烯中可与
中,则氧化石墨烯中可与 形成氢键的原子有
形成氢键的原子有(3)丁二酮肟与
 生成鲜红色丁二酮肟镍沉淀(如图①),该反应可用于检验
生成鲜红色丁二酮肟镍沉淀(如图①),该反应可用于检验 。丁二酮肟镍中存在的化学键有
。丁二酮肟镍中存在的化学键有A.配位键 B.氢键 C.金属键 D.范德华力 E.共价键

(4)碳的某种晶体为层状结构,可与熔融金属钾作用。钾原子填充在各层之间,形成间隙化合物,其常见结构的平面投影如图②所示,则其化学式可表示为
(5)碳和钨(W)组成一种晶体,其熔点为2870℃,硬度接近金刚石,其晶胞结构如图所示,则其化学式为

您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】回答以下关于元素及其化合物的问题.
(1)下列状态的铝中,最外层电离出一个电子所需要能量由大到小的顺序______________ (填标号)。______________ ,基态氧原子的价层电子不是重排结构,原因是不符合______________ 。
(3)下图中分别代表了碳单质的两种常见晶体,碳元素位于元素周期表的______________ 区;图1晶体中1个最小六元环平均含有C原子数与图2晶体中1个最小六元环平均含有C原子数之比为______________ ;图3是石墨层间插入氟得到层状结构化合物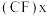 ,该物质仍具润滑性,与石墨相比,
,该物质仍具润滑性,与石墨相比,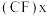 导电性
导电性______________ (填“增强”或“减弱”)。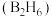 、丁硼烷
、丁硼烷 等.乙硼烷的结构式如图
等.乙硼烷的结构式如图 。分子中B原子通过氢桥键(
。分子中B原子通过氢桥键(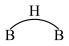 )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式______________ 。
(1)下列状态的铝中,最外层电离出一个电子所需要能量由大到小的顺序
A.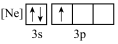 B.
B.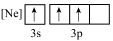 C.
C.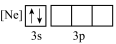 D.
D.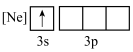
(3)下图中分别代表了碳单质的两种常见晶体,碳元素位于元素周期表的
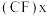 ,该物质仍具润滑性,与石墨相比,
,该物质仍具润滑性,与石墨相比,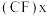 导电性
导电性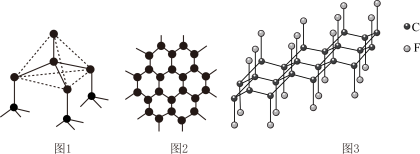
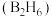 、丁硼烷
、丁硼烷 等.乙硼烷的结构式如图
等.乙硼烷的结构式如图 。分子中B原子通过氢桥键(
。分子中B原子通过氢桥键( )形成一个四元环。丁硼烷
)形成一个四元环。丁硼烷 分子中存在4个氢桥键且有两个五元环,写出其结构式
分子中存在4个氢桥键且有两个五元环,写出其结构式
您最近一年使用:0次



