在实验室可用图1所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.
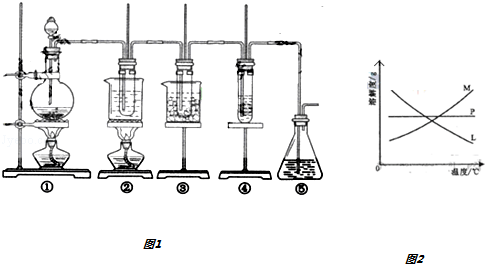
图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
(l)写出钾离子的结构示意图__________ .
(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有__________ (选填下列字母)的净化装置.
(3)比较制取氯酸钾和次氯酸钠的条件,二者的差异是:_________ .反应完毕经冷却后,②的试管中有大量晶体析出,分离出该晶体的方法是_____________ (填写实验操作名称).图2中符合该晶体溶解度曲线的是__________ (填写编号)
(4)本实验中制取次氯酸钠的离子方程式是:__________
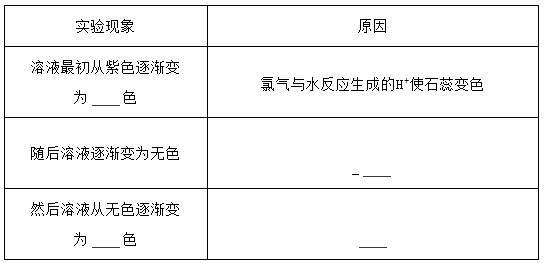
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:__________

图中:①为氯气发生装置;
②的试管里盛有15mL30%KOH 溶液.并置于热水浴中;
③的试管里盛有15mL 8% NaOH 溶液.并置于冰水浴中;
④的试管里加有紫色石蕊溶液; ⑤为尾气吸收装置.
请填写下列空白:
(l)写出钾离子的结构示意图
(2)制取氯气时,在烧瓶里加入一定量的二氧化锰,向烧瓶中加入适量的浓盐酸.实验时为了除去氯气中的氯化氢气体,可在①与②之间安装盛有
| A.碱石灰 | B.饱和食盐水 | C.浓硫酸 | D.饱和碳酸氢钠溶液 |
(4)本实验中制取次氯酸钠的离子方程式是:
(5)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写下表中的空白:

更新时间:2016-12-09 11:05:35
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
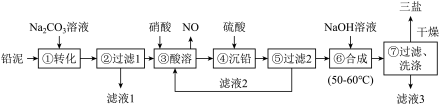
【推荐1】三盐(3PbO·PbSO4·H2O)可用作聚氯乙烯的热稳定剂,200℃以上开始失去结晶水,不溶于水及有机溶剂。以200.0t铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如图所示。
已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
(1)步骤①转化的目的是_______ ,滤液1中的溶质为Na2CO3和_______ (填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是_________ (任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________ 。
(3)滤液2中可循环利用的溶质的化学式为_______ 。若步骤④沉铅后的滤液中c(Pb2+)=1.82×10-5mol/L,则此时c(SO42-)=______ mol/L。
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是________________ 。
(5)步骤⑥合成三盐的化学方程式为____________ ,若得到纯净干燥的三盐99.Ot,假设铅泥中的铅元素有80%转化为三盐,则铅泥中铅元素的质量分数为________ 。

已知:PbSO4和PbCO3的溶解度和溶度积Ksp如下表。
| 化合物 | PbSO4 | PbCO3 |
| 溶解度/g | 1.03×10-4 | 1.81×10-7 |
| Ksp | 1.82×10-8 | 1.46×10-13 |
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是
(3)滤液2中可循环利用的溶质的化学式为
(4)步骤⑦洗涤操作时,检验沉淀是否洗涤完全的方法是
(5)步骤⑥合成三盐的化学方程式为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
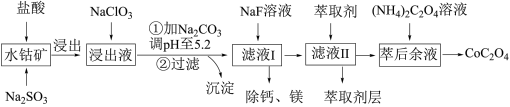
【推荐2】草酸钴用途广泛,可用于指示剂和催化剂制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
(1)浸出过程中加入Na2SO3的目的是将_____________ 还原(填离子符号)以便固体溶解。该步反应的离子方程式为____________________ (写一个)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为____________________ 。
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是____________________ 。
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是________ ;使用萃取剂适宜的pH=____ (填序号)左右:

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=__________ 。

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 完全沉淀的pH | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,氯元素被还原为最低价。该反应的离子方程式为
(3)利用平衡移动原理分析:加Na2CO3能使浸出液中Fe3+、Al3+转化成氢氧化物沉淀的原因是
(4)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是

A.2.0 B.3.0 C. 4.0
(5)滤液Ⅰ“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/c(Ca2+)=
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
解题方法
【推荐3】高铁酸盐 是优良的多功能水处理剂。
是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:
某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:
制备 (装置如图所示,夹持、加热等装置略)
(装置如图所示,夹持、加热等装置略)
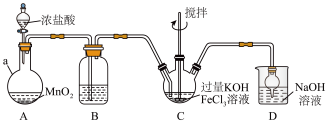
(1)仪器 的名称是
的名称是______ ,装置B中除杂质所用试剂是______ 。
(2)C中发生反应的离子方程式为______ 。
(3) 中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为,
中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为,______ ,反应中 必须过量的原因是
必须过量的原因是______ 。
(4)D中反应可制备漂白液,反应的离子方程式为______ 。
(5) 中由
中由 制备
制备 ,若生成
,若生成 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目______ 。
 是优良的多功能水处理剂。
是优良的多功能水处理剂。 为紫色固体,可溶于水,微溶于浓
为紫色固体,可溶于水,微溶于浓 溶液,难溶于有机物;在
溶液,难溶于有机物;在 、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出
、强碱性溶液中比较稳定,在酸性、中性溶液中易分解放出 某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:
某实验小组制备高铁酸钾并测定产品纯度。回答下列问题:制备
 (装置如图所示,夹持、加热等装置略)
(装置如图所示,夹持、加热等装置略)
(1)仪器
 的名称是
的名称是(2)C中发生反应的离子方程式为
(3)
 中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为,
中反应为放热反应,而反应温度须控制在0∼5℃,采用的控温方法为, 必须过量的原因是
必须过量的原因是(4)D中反应可制备漂白液,反应的离子方程式为
(5)
 中由
中由 制备
制备 ,若生成
,若生成 ,则该反应过程中转移的电子数目
,则该反应过程中转移的电子数目
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐1】二氯化二硫 可作硫化剂、氯化剂。常温下,
可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。
(1)选用以下装置制取少量 (加热及夹持装置略)。
(加热及夹持装置略)。

①写出A中发生反应的化学方程式_______ 。
②装置连接顺序:A→_______ 。
③B中玻璃纤维的作用是什么_______ ?
④D中盛放的试剂是什么_______ ?
(2) 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。

①W溶液可以是下列溶液中的_______ (填标号)。
a. 溶液 b.酸性
溶液 b.酸性 溶液 C.氯水 d.
溶液 C.氯水 d. 溶液
溶液
②计算混合气体中 的体积分数
的体积分数______ (用含 、
、 的代数式表示,不要求计算过程)。
的代数式表示,不要求计算过程)。
 可作硫化剂、氯化剂。常温下,
可作硫化剂、氯化剂。常温下, 是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。
是一种黄红色液体,沸点137℃,在潮湿的空气中剧烈水解而发烟。 可通过硫与少量氯气在110~140℃反应制得。
可通过硫与少量氯气在110~140℃反应制得。(1)选用以下装置制取少量
 (加热及夹持装置略)。
(加热及夹持装置略)。
①写出A中发生反应的化学方程式
②装置连接顺序:A→
③B中玻璃纤维的作用是什么
④D中盛放的试剂是什么
(2)
 遇水会生成
遇水会生成 、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中
、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中 的体积分数。
的体积分数。
①W溶液可以是下列溶液中的
a.
 溶液 b.酸性
溶液 b.酸性 溶液 C.氯水 d.
溶液 C.氯水 d. 溶液
溶液②计算混合气体中
 的体积分数
的体积分数 、
、 的代数式表示,不要求计算过程)。
的代数式表示,不要求计算过程)。
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
【推荐2】长期存放的亚硫酸钠可能会被空气中的氧气氧化。某化学兴趣小组通过实验来测定亚硫酸钠试剂被氧化的程度,设计了如图实验,请回答下面的问题:

(1)D装置中反应的化学方程式为_______ 。B装置中反应的离子方程为_______ 。
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:_______ 。
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加_______ C装置中的作用是 _______ 。
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为:_______ 。(填试剂编号)

(1)D装置中反应的化学方程式为
(2)称量ag Na2SO3样品放入锥形瓶中,向B装置反应后的溶液中加入足量的BaCl2溶液充分反应、过滤、洗涤、干燥,得白色沉淀bg,原样品中Na2SO3的质量分为数为:
(3)为保证实验测定的准确性,A中的硫酸什么时候滴加
(4)现有以下试剂:①蒸馏水、②稀盐酸、③稀硝酸、④BaCl2溶液、⑤Ba(NO3)2溶液,请从中选择合适试剂,设计一种不同的实验方法,测定试样中无水亚硫酸钠被氧化的程度,你使用试剂的顺序为:
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
【推荐3】亚硝酰氯(NOCl,熔点:-64.5 ℃,沸点:0.5 ℃,有毒)常温下是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成,并以液态储存 。
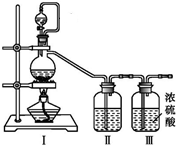
(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:_______
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
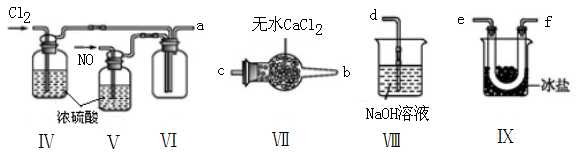
①装置连接顺序为a→____________________________ (按气流自左向右方向,用小写字母表示)。
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是______________________________ 。
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?_________________________ 。
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为___________________ 。

(1)甲组的同学拟制备原料气NO和Cl2,均采用上图制备装置:
①写出NOCl的N元素化合价:
②为制备纯净干燥的气体,下表中缺少的药品是(填写在横线上):
| 实验项目 | 装置Ⅰ | 装置Ⅱ | |
| 制备的气体 | 烧瓶中 | 分液漏斗中 | |
| a .制备纯净干燥的Cl2 | MnO2 | ||
| b .制备纯净干燥的NO | Cu | ||

①装置连接顺序为a→
②装置Ⅳ、Ⅴ除可进一步干燥NO、Cl2外,另一个作用是
③装置Ⅵ在实验结束,拆解装置前,应作怎样的处理?
④装置Ⅷ中吸收尾气时,NOCl发生的非氧化还原反应的化学方程式为
您最近一年使用:0次



