一定温度下,在2L密闭容器中发生反应:2SO2(g)+O2(g)⇌2SO3(g)△H=﹣196kJ•mol﹣1
①当充入2.8molSO2和1.2molO2发生反应,达到平衡时气体的总压强为原来的90%,则该反应的平衡常数为_________ ,若再充入O2、SO3各0.2mol,此时v正_________ v逆(填写“>”,“=”或“<”).
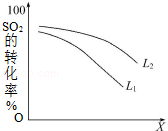
②L(L1、L2)、X可分别代表压强或温度.如图表示L一定时,该反应的平衡转化率随X的变化关系.X代表的物理量是_________ .判断L1、L2的大小关系,并简述理由:__________ .

①当充入2.8molSO2和1.2molO2发生反应,达到平衡时气体的总压强为原来的90%,则该反应的平衡常数为
②L(L1、L2)、X可分别代表压强或温度.如图表示L一定时,该反应的平衡转化率随X的变化关系.X代表的物理量是
更新时间:2016-12-09 03:17:52
|
【知识点】 化学平衡
相似题推荐
填空题
|
较难
(0.4)
名校
解题方法
【推荐1】1,3-丁二烯(A)可以与等物质的量的HBr发生加成反应,得到1,2-加成和1,4-加成两种加成产物C和D(如下图I)。该反应经过了以下两个步骤:(1)1,3-丁二烯(A)与H+结合生成碳正离子中间体(B)(反应①);(2)Br-进攻碳正离子中间体B得到产物C或者D(反应②和③)。在0 ℃和40 ℃时,两种产物的分配比例如表Ⅱ所示。图Ⅲ示出了该反应进程中的能量变化。 
(1)试写出1,3-丁二烯与等物质的量的HBr生成更稳定产物的化学方程式_______ 。
(2)与0 ℃相比,40 ℃时1,3-丁二烯的平衡转化率_____________ (选填“增大”、“减小”或“不变”)。
(3)对于由多个步骤组成的复杂反应,活化能最高的步骤称为决速步。在上述反应中,决速步为第________ 步(选填①、②或③)。升高反应温度,对反应________ (选填①、②或③)的速率影响最大。
(4)当反应温度从0 ℃升至40 ℃,反应②的正反应速率_________ (选填“增大”、“减小” 或“不变”),逆反应速率 _______ (选填“增大”、“减小” 或“不变”),且正反应速率变化程度______________ (选填“大于”、“小于” 或 “等于”)逆反应速率变化程度。
(5)经动力学实验测定,上述三个反应的正反应速率可分别表示为:v1=k1c(A)c(H+);v2=k2c(B)c(Br-);v3=k3c(B)c(Br-)。其中k1,k2,k3分别为三个反应的速率常数,它们与对应反应的活化能呈负相关关系。试将k1,k2,k3 按由大到小的顺序排序:_____________ 。若k1≪(k2 +k3),则下列各图中最能准确描绘各物种浓度随时间变化的曲线是 ________ (选填序号)(此时不考虑三个反应的逆反应)。(x 代表反应物 A 的浓度,y 代表中间体 B 的浓度,z 代表产物 C 与产物 D 的浓度之和)


(1)试写出1,3-丁二烯与等物质的量的HBr生成更稳定产物的化学方程式
(2)与0 ℃相比,40 ℃时1,3-丁二烯的平衡转化率
(3)对于由多个步骤组成的复杂反应,活化能最高的步骤称为决速步。在上述反应中,决速步为第
(4)当反应温度从0 ℃升至40 ℃,反应②的正反应速率
(5)经动力学实验测定,上述三个反应的正反应速率可分别表示为:v1=k1c(A)c(H+);v2=k2c(B)c(Br-);v3=k3c(B)c(Br-)。其中k1,k2,k3分别为三个反应的速率常数,它们与对应反应的活化能呈负相关关系。试将k1,k2,k3 按由大到小的顺序排序:

您最近一年使用:0次
填空题
|
较难
(0.4)
【推荐2】已知N2O4和NO2可以相互转化:2NO2(g) N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
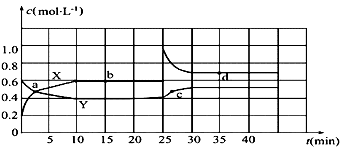
(1)图中曲线______(填“X”或“Y”)表示c(N2O4)随时间的变化。
(2)从起点开始首次达到平衡时,以NO2表示的反应速率为______。
(3)图中b点的平衡常数K的值为________。
(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,则v正_____v逆(填“>”、“=”或“<”);若升温该反应的平衡常数K______(填“增大”、“减小”或“不变”) ,判断理由是_________________。
(5)25min时,改变的外界条件是______,图象中a、b、c、d四点中v正=v逆的点是____,四点中________点体系颜色最深。
 N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
N2O4(g) △H<0现将一定量N2O4和NO2的混合气体通入体积为2L的恒温密闭玻璃容器中,发生反应,各物质浓度随时间变化关系如图:
(1)图中曲线______(填“X”或“Y”)表示c(N2O4)随时间的变化。
(2)从起点开始首次达到平衡时,以NO2表示的反应速率为______。
(3)图中b点的平衡常数K的值为________。
(4)其他条件不变,若起始时向该容器中通入0.4molN2O4和0.2molNO2,则v正_____v逆(填“>”、“=”或“<”);若升温该反应的平衡常数K______(填“增大”、“减小”或“不变”) ,判断理由是_________________。
(5)25min时,改变的外界条件是______,图象中a、b、c、d四点中v正=v逆的点是____,四点中________点体系颜色最深。
您最近一年使用:0次
填空题
|
较难
(0.4)
解题方法
【推荐3】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。
CH3OH(g)。
图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线____ (填:a或b)表示使用了催化剂;该反应属于____ (填:吸热、放热)反应。
(2)下列说法正确的是______ ;
(3)从反应开始到建立平衡, v(H2)=_____ ;该温度下CO(g)+2H2(g) CH3OH(g)的化学平衡常数为
CH3OH(g)的化学平衡常数为______ 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数________ (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线____________ (在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式____________________ 。
 CH3OH(g)。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。

请回答下列问题:
(1)在“图1”中,曲线
(2)下列说法正确的是
| A.起始充入的CO为2mol |
| B.增加CO浓度,CO的转化率增大 |
| C.容器中压强恒定时,反应已达平衡状态 |
| D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小 |
(3)从反应开始到建立平衡, v(H2)=
 CH3OH(g)的化学平衡常数为
CH3OH(g)的化学平衡常数为(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式
您最近一年使用:0次



