在一定条件下有以下转化关系,已知A、B、C中均含有同种元素。请回答下列问题。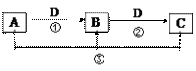
(1)若D为日常生活中最常见的金属单质之一,且以上反应均为氧化还原反应;除以上四种物质外,整个转化过程中没有其它物质参与或生成。
①构成D单质的元素在周期表中的位置是_______ ;
②反应③的离子方程式_______ 。
③试叙述检验物质B中阳离子的实验方法_______ 。
(2)若无反应③的转化过程,C为红棕色气体,试分析:
①A、B、C中含有的共同元素为(写名称):_______ 。
②C与H2O反应的化学方程式为_______ 。
③若A为化合物时其电子式为_______ 。
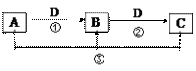
(1)若D为日常生活中最常见的金属单质之一,且以上反应均为氧化还原反应;除以上四种物质外,整个转化过程中没有其它物质参与或生成。
①构成D单质的元素在周期表中的位置是
②反应③的离子方程式
③试叙述检验物质B中阳离子的实验方法
(2)若无反应③的转化过程,C为红棕色气体,试分析:
①A、B、C中含有的共同元素为(写名称):
②C与H2O反应的化学方程式为
③若A为化合物时其电子式为
10-11高三上·山东泰安·期中 查看更多[1]
(已下线)2011届山东省宁阳一中高三上学期期中考试化学试卷
更新时间:2010-12-03 09:12:03
|
相似题推荐
填空题
|
适中
(0.65)
解题方法
【推荐1】电解熔融氯化钙可以得到金属钙和氯气,钙在氯气中燃烧又能生成氯化钙。请根据已有知识,按下图箭头符号所表示的物质间发生的转化,写出相应反应的化学方程式,并指出哪些是氧化还原反应。
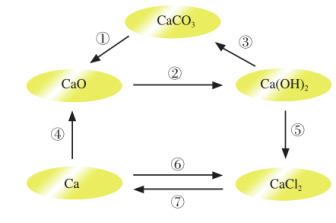
①_______ ;②_______ ;③_______ ;④_______ ;⑤_______ ;⑥_______ ;⑦_______ ;哪些反应是氧化还原反应_______ 。

①
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐2】X、Y、Z、W四种物质有如下相互转化关系(其中X、W单质,Y、Z为化合物,未列出反应条件)。

Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是__________ 。
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途_____________________ 。
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是_______________________________________________________ 。
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO40.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因_________________________________________________ 。

(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO410 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
①________________________________________________________ ,
原因是_________________________________________________________________ 。
②_______________________________________________________ ,
原因是________________________________________________________________ 。

Ⅰ.若Z是生活中常用的调味品,W遇淀粉溶液变蓝,则:
(1)常温下,X的颜色是
(2)工业上Z有多种用途,用化学方程式表示Z的一种用途
(3)生活中所用的Z加入了碘酸钾,过量X与Y溶液反应时可以得到一种碘酸盐,此反应的离子方程式是
Ⅱ.下面是某化学课外活动小组研究浓H2SO4的氧化性的结论并进行了实验验证:
①一般认为H2SO4浓度大于60%,就具有一定的强氧化性,越浓氧化性越强,60%以下的H2SO4主要体现的是酸性,基本上不体现强氧化性。
②温度也影响氧化性,如铜放于冷的浓H2SO4中反应不明显,如果加热就可以观察到明显现象。
③98%的浓H2SO4物质的量浓度为18.4 mol/L,密度为1.84 g·cm-3,根据以上信息回答:
(1)如图装置,同学甲先向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗中加98%的浓H2SO40.5 mL,加热至沸腾,该试管中液体没有明显变化,试用数据解释
原因

(2)乙同学利用所示装置直接从分液漏斗中再加浓H2SO410 mL与铜片反应。在左边试管中所观察到与甲不同的现象除了有黑色物质出现外,还有
①
原因是
②
原因是
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】(Ⅰ)磷是生物体中不可缺少的元素之一,在自然界中磷总是以磷酸盐的形式出现的,例如磷酸钙矿Ca3(PO4)2、磷灰石Ca5F(PO4)3等.
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为 .
(2)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中(约1550℃)下通过下面两个反应共熔得到.
①2Ca3(PO4)2(s)+5C(s)═6CaO(s)+P4(s)+5CO2(g)△H1=+Q1kJ•mol﹣1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣Q2kJ•mol﹣1
写出电炉中发生总反应的热化学方程式 .
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10;10C+P4O10=P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有 .
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 .

(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 .
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 .
(1)磷的某种核素中,中子数比质子数多1,则表示该核素的原子符号为 .
(2)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中(约1550℃)下通过下面两个反应共熔得到.
①2Ca3(PO4)2(s)+5C(s)═6CaO(s)+P4(s)+5CO2(g)△H1=+Q1kJ•mol﹣1
②CaO(s)+SiO2(s)═CaSiO3(s)△H2=﹣Q2kJ•mol﹣1
写出电炉中发生总反应的热化学方程式 .
(3)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4)2+6SiO2=6CaSiO3+P4O10;10C+P4O10=P4↑+10CO↑,上述反应中的各种物质,属于酸性氧化物的有 .
(Ⅱ)离子交换膜是一类具有离子交换功能的高分子材料.一容器被离子交换膜分成左右两部分,如右图所示.若该交换膜为阳离子交换膜(只允许阳离子自由通过),左边充满盐酸酸化的H2O2溶液,右边充满滴有KSCN溶液的FeCl2溶液(足量),一段时间后右边可观察到的现象: ,若该交换膜为阴离子交换膜(只允许阴离子自由通过),左边充满含2mol NH4Al(SO4)2的溶液,右边充满含3mol Ba(OH)2的溶液,当有2mol SO42﹣通过交换膜时(若反应迅速完全),则左右两室沉淀的物质的量之比为 .

(Ⅲ)某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,利用相关工艺可进行提纯与综合利用.通入一定量的N2后,在1500℃下与Cl2充分反应得到纯化石墨与气体混合物,然后降温至80℃,分别得到不同状态的两类物质a和b.(注:石墨中氧化物杂质均转变为相应的氯化物,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃.)
(1)若a与过量的NaOH溶液反应,可得两种盐,其中一种盐的水溶液具有粘合性,化学反应方程式为 .
(2)若b与过量的NaOH溶液充分反应后,过滤,所得滤液中阴离子有 .
您最近一年使用:0次
填空题
|
适中
(0.65)
【推荐1】铁及其化合物在生产生活中具有广泛应用。一定条件下,铁及其化合物之间可以发生相互的转化。
(1)在给定条件下,下列选项所示的物质间转化均能实现的是_______。
(2) 可完全水解成
可完全水解成 ,水解反应的离子方程式:
,水解反应的离子方程式:_______ 。
(3)三草酸合铁酸钾是制备负载型活性催化剂的主要原料,易溶于水,难溶于乙醇。实验室制备流程如下:

①“溶解”时加入硫酸的目的是_______ 。
②“沉淀”得到 晶体,“沉淀”时发生反应的离子方程式为
晶体,“沉淀”时发生反应的离子方程式为_______ 。
③制备 晶体。
晶体。
【查阅资料】
a) 溶于水;
溶于水;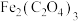 难溶于水。
难溶于水。
b)实验条件下, 时,
时, 沉淀完全;过氧化氢在
沉淀完全;过氧化氢在 发生显著分解。
发生显著分解。
c)铁氰化钾( )溶液与
)溶液与 反应产生深蓝色沉淀,与
反应产生深蓝色沉淀,与 不反应。
不反应。
i)以 晶体作为原料,制备
晶体作为原料,制备 晶体时,请补充完整相应的实验方案:取一定量的
晶体时,请补充完整相应的实验方案:取一定量的 晶体,边加入饱和
晶体,边加入饱和 溶液边搅拌,至
溶液边搅拌,至 约为3,
约为3,_______ ,过滤、晾干、得到 晶体。(实验中须使用的试剂:
晶体。(实验中须使用的试剂: 溶液,饱和
溶液,饱和 溶液,无水乙醇,
溶液,无水乙醇, 溶液。)
溶液。)
ii)通过下列方法测定产品纯度:准确称取 样品,加入适量水溶解并用稀硫酸酸化,加热至
样品,加入适量水溶解并用稀硫酸酸化,加热至 ,趁热用
,趁热用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。计算样品的纯度
。计算样品的纯度_______ (写出计算过程)。
(1)在给定条件下,下列选项所示的物质间转化均能实现的是_______。
A. |
B. |
C. |
D. |
 可完全水解成
可完全水解成 ,水解反应的离子方程式:
,水解反应的离子方程式:(3)三草酸合铁酸钾是制备负载型活性催化剂的主要原料,易溶于水,难溶于乙醇。实验室制备流程如下:

①“溶解”时加入硫酸的目的是
②“沉淀”得到
 晶体,“沉淀”时发生反应的离子方程式为
晶体,“沉淀”时发生反应的离子方程式为③制备
 晶体。
晶体。【查阅资料】
a)
 溶于水;
溶于水;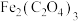 难溶于水。
难溶于水。b)实验条件下,
 时,
时, 沉淀完全;过氧化氢在
沉淀完全;过氧化氢在 发生显著分解。
发生显著分解。c)铁氰化钾(
 )溶液与
)溶液与 反应产生深蓝色沉淀,与
反应产生深蓝色沉淀,与 不反应。
不反应。i)以
 晶体作为原料,制备
晶体作为原料,制备 晶体时,请补充完整相应的实验方案:取一定量的
晶体时,请补充完整相应的实验方案:取一定量的 晶体,边加入饱和
晶体,边加入饱和 溶液边搅拌,至
溶液边搅拌,至 约为3,
约为3, 晶体。(实验中须使用的试剂:
晶体。(实验中须使用的试剂: 溶液,饱和
溶液,饱和 溶液,无水乙醇,
溶液,无水乙醇, 溶液。)
溶液。)ii)通过下列方法测定产品纯度:准确称取
 样品,加入适量水溶解并用稀硫酸酸化,加热至
样品,加入适量水溶解并用稀硫酸酸化,加热至 ,趁热用
,趁热用 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 标准溶液
标准溶液 。计算样品的纯度
。计算样品的纯度
您最近一年使用:0次
填空题
|
适中
(0.65)
名校
解题方法
【推荐2】已知A、B、C为中学化学中常见的单质, A为是生产、生活中用量最大、用途最广的金属单质,室温下B是黄绿色气体,C为无色气体。在一定条件下相互转化的关系如图所示。

请回答以下问题:
(1)A、B、C分别是什么物质:A是___ ,B是__ ,C是____ ,F是___ (填化学式)
(2)写出A和B生成D的化学方程式:____________________________ ,向D溶液中加入________ 溶液可看到溶液变血红色。
(3)写出F溶液中加入B的离子方程式:________________________ 。

请回答以下问题:
(1)A、B、C分别是什么物质:A是
(2)写出A和B生成D的化学方程式:
(3)写出F溶液中加入B的离子方程式:
您最近一年使用:0次
填空题
|
适中
(0.65)
解题方法
【推荐3】阅读下面两条科普信息,回答有关问题:
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有______ 性,铁离子具有_______ 性,第二则则信息中CO2是_________ 剂。
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
__ Fe(NO3)3 +__ NaOH+ __ Cl2 → __ Na2FeO4+ __ NaNO3 + __ NaCl + __ H2O
①配平上述反应,并分析_______ 元素被氧化,当生成3mol还原产物时,转移电子的总数为______ ;
②铁酸钠除了能消毒外,还可以用于净水,原因是_____________________ 。
一个体重50kg的健康人身体中含铁2g,这2g铁在人体中不是以金属单质的形式存在,而是以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收:
在新生代的海水里有一种铁细菌,它们提取海水中的亚铁离子,利用酶为催化剂把它转变成它们的皮鞘(可以用Fe2O3来表示其中的铁),后来便沉积下来形成铁矿:该反应的另一种反应物是CO2,反应后CO2转变成有机物(用甲醛CH2O表示)。
(1)这两则科普信息分别介绍了人体内和海水中的亚铁离子与铁离子(或者铁的高价化合物)相互转化的事实、方法和途径。这说明维生素C具有
(2)铁酸钠(Na2FeO4)是水处理过程中使用的一种新型净水剂,它的氧化性比高锰酸钾更强,本身在反应中被还原为Fe3+离子。制取铁酸钠的化学方程式如下:
①配平上述反应,并分析
②铁酸钠除了能消毒外,还可以用于净水,原因是
您最近一年使用:0次



